Articles
- Page Path
- HOME > J Powder Mater > Volume 30(3); 2023 > Article
-
Article
자전연소합성법을 이용한 Cr 분말 제조시 산세조건에 따른 물성평가 - 이용관a,b, 조영우c, 최신영d, 허성규a,b, 주 원a, 박경태a, 이미혜a,*, 심재진a,*
- Effect of Acid Leaching Conditions on the Properties of Cr Powder Produced by Self-propagating High-temperature Synthesis
- YongKwan Leea,b, YeongWoo Choc, ShinYoung Choid, SungGue Heoa,b, Ju Wona, KyoungTae Parka, MiHye Leea,*, JaeJin Sima,*
-
Journal of Korean Powder Metallurgy Institute 2023;30(3):233-241.
DOI: https://doi.org/10.4150/KPMI.2023.30.3.233
Published online: May 31, 2023
a 한국생산기술연구원
b 고려대학교 신소재공학과
c 비츠로셀
d 영풍
a Korea Institute of Industrial Technology, Incheon 21655, Republic of Korea
b Department of Materials Science and Engineering, Korea University, Seoul 02841, Republic of Korea
c VITZRO CELLl Co., Ltd., Dangjin 31816, Republic of Korea
d YOUNG POONG Co., Ltd., Ansan 15604, Republic of Korea
-
* Corresponding Author: MiHye Lee, TEL: +82-10-7232-6849, FAX: +82-32-226-1373, E-mail: lmh62@kitech.re.kr
JaeJin Sim, TEL: +82-10-8911-5774, FAX: +82-32-226-1373, E-mail: simjae@kitech.re.kr - - 이용관·허성규: 학생, 조영우·최신영·주 원·이미혜: 연구원, 박경태: 수석연구원, 심재진: 선임연구원
© The Korean Powder Metallurgy Institute. All rights reserved.
- 766 Views
- 3 Download
Abstract
- In this study, we evaluated the effects of acid leaching on the properties of Cr powder synthesized using self-propagating high-temperature synthesis (SHS). Cr powder was synthesized from a mixture of Cr2O3 and magnesium (Mg) powders using the SHS Process, and the byproducts after the reaction were removed using acid leaching. The properties of the recovered Cr powder were analyzed via X-ray diffraction (XRD), scanning electron microscopy (SEM), energy-dispersive X-ray spectroscopy (EDS), particle size analysis (PSA), and oxygen content analysis. The results show that perfect selective leaching of Cr is challenging because of various factors such as incomplete reaction, reaction kinetics, the presence of impurities, and incompatibility between the acid and metal mixture. Therefore, this study provides essential information on the properties under acidic conditions during the production of high-quality Cr powder using a self-propagating high-temperature synthesis method.
- 크롬은 1,907°C의 높은 융점, 모스 경도 8.5의 높은 경 도, 부식에 대한 우수한 내식성, 고온에서의 안정성 등과 같은 물리적 특성으로 인해 항공 우주, 자동차, 전자, 야금 등 다양한 산업 분야에서 널리 사용되고 있다. 주로 사용 되는 분야는 금속 야금으로, 부식 확산 대비를 위한 철계 제품 첨가제[1], 우수한 경도 및 연신율, 열팽창계수를 활 용한 Ni계 합금 및 부식저항성, 강도 향상을 위한 Co계 합 금[2] 등이 있다. 또한 모재와의 결합 안정성 및 부식 안 정성이 우수하여 표면 코팅 등에도 이용되고 있으며[3], 일부 고순도 Cr의 경우 스퍼터링 타겟[4]을 제작하여 활용 한다. 상기 기술한 바와 같이 다양한 분야에서 사용 가능 하기 때문에, 비용 및 시간, 환경적 측면에서 효율적인 제 조 방법 개발이 필수적이다.
- Cr2O3를 활용하여 고순도 Cr 분말 제조 시 가장 일반적 인 공정으로는 알루미늄 환원법이 있다. 이는 Cr2O3와 알 루미늄(Al) 분말을 혼합하여 고온·고압에서 반응시키는 방 법[5]으로 이 반응에서 Cr 금속이 생성된다. 하지만, 알루 미늄에 의한 중간화합물 및 합금에 의한 오염이 발생할 수 있다[6]. 또 다른 공정으로는 전기분해를 이용하여 고 순도 Cr 분말 제조 공정도 있으며, 이는 CrCl2 펠렛 제조 후 전기분해를 통해 Cr 분말을 제조한다. 앞선 방식과 달 리 알루미늄을 사용하지 않기에 상대적으로 공정비용을 줄일 수 있으나, 펠렛을 제조해야 하고 산소함량을 줄이기 위해 장시간 공정을 진행해야 하는 단점이 있다[7].
- 탄소열환원 공정을 통해 Cr2O3를 Cr로 환원하는 방법도 존재하는데, 약 1,100~1,400°C의 고온에서 CrO2와 C를 반 응시켜 Cr-C 화합물을 형성시키고, 형성 도중 생성된 CO 및 CO2 기체를 활용하여 최종적으로 Cr 금속으로 환원시 키는 방법이다[8]. 다만 이 공정의 경우, 중간 화합물로 다 양한 Cr-C 화합물(Cr2C3, Cr7C3, Cr23C6)이 형성되어 잔류 할 수 있기 때문에 환원율을 높이기 위한 주입 기체의 속 도와 투입 C의 입도 등을 세밀하게 조정할 필요가 있다. 이러한 공정을 이용하여 보다 낮은 온도에서 적은 중간화 합물을 형성하게 하고, 원광(크롬광)까지 환원하기 위해 메탄이 포함된 Gas를 사용하는 방법이 개발되었으나[9], 여전히 중간화합물이 존재하기 때문에 이를 감소시키는 연구가 현재 진행 중에 있다.
- 이외에도 크롬광을 황산에 녹인 후 전기분해 공정을 통 해 Cr를 얻는 방법도 있으며[10], 이는 세밀한 pH 조정이 필요하고 황산 사용에 따라 다른 공정들에 비해 친환경적 이지 않고 장시간 진행해야 하는 단점이 있다. 수소환원을 통해 크롬광으로부터 Cr 금속을 확보 가능하긴 하지만, Mg나 Al 등의 금속이 같이 있다면 부산물이 추가되어 이 를 제거하는 추가 공정이 필요한 것으로 확인된다[11]. 이 에 본 연구에서는 자전연소합성법을 이용하여 Cr2O3로부 터 Cr 금속 분말을 확보하는 연구를 수행하였다. 환원제 및 희석제를 통해 고온으로 단시간 내에 공정을 진행하며 중간화합물인 Cr-C 계열을 형성하지 않고 희석제로 인한 입자 성장 제어가 가능한 공정이다. 또한, 다른 금속 제조 방식과 다르게 분말 형태로 환원되기 때문에, 파쇄 및 밀 링을 통한 후처리 공정이 필요하지 않아 분말의 입도 편 차가 크지 않다는 강점이 있다. 본 연구에서는 안정적 연 소합성 조건을 도출하였으며, 산화가 용이한 Cr 분말을 산 화시키지 않고, 반응부산물인 Mg, MgO, Mg-Cr-O 복합상 을 제거하기 위한 산침출 공정조건(용매종류, 첨가량, 리 칭시간 등)을 도출하기 위해 실험을 진행하였다.
1. Introduction
- 2.1 재료
- 본 연구를 진행하기 위해서 다음과 같은 물질 및 재료 들을 사용하였다. 산화 크로뮴 분말(Cr2O3, purity, 98.5%; SAMCHUN PURE CHEMICAL CO., LTD. Republic of Korea), 마그네슘(Mg, purity, 98%; SAMCHUN PURE CHEMICAL CO., LTD. Republic of Korea), 염화나트륨 (NaCl, purity, 99%; SAMCHUN PURE CHEMICAL CO., LTD. Republic of Korea), 17 M 아세트산(CH3COOH, SAMCHUN PURE CHEMICAL CO., LTD. Republic of Korea), 16M 질산(HNO3, SAMCHUN PURE CHEMICAL CO., LTD. Republic of Korea)을 사용하였다. 산화 크롬의 환원은 마그네슘 분말만 사용하여 실험을 진행하였으며, 점화를 위한 추가 열원부여 물질은 사용하지 않았다. 반응 부산물 및 미반응 원료 제거를 위해 고려된 물질은 질산, 아세트산을 선택하였으며, 이는 합성된 크롬분말은 화학 적으로 안정된 금속이나 황산에만 반응성이 높은 금속으 로 알려져 있다[12]. 따라서, 황산을 제외하고 반응부산물 제거에 적합한 질산을 선택하여 사용하였다. 또한, 미반응 한 Cr2O3 제거를 위해 Cr2O3와의 반응성이 높은 아세트산 을 선택하여 사용하였다[13].
- 2.2 실험 방법
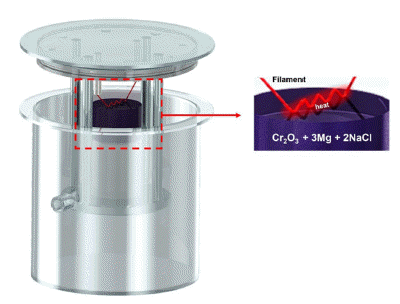
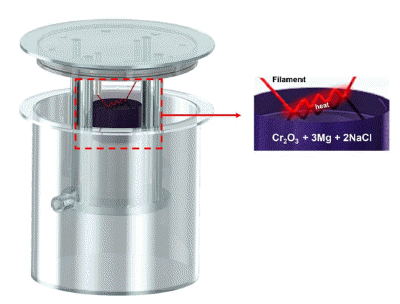
- 본 실험에 사용된 자전연소고온합성장치는 최대 30L까 지 투입 가능한 크기로 제작하였다. 또한, 내부 최대 압력 을 150 bar까지 견딜 수 있도록 내압 설계 및 자동 가스 배출장치를 제작하였다. 다른 부가적 장치로는 아르곤 가 스 주입구를 장착하였으며, 연소반응 온도 및 내부기압 데 이터 수집을 위해 C-type 열전대(Ø 100 μm, W-5%Re / W-26%Re) 및 디지털 압력 게이지를 설치하였다. 본 연구 에 사용된 자전연소고온합성장치의 모식도는 Fig. 1에 나 타내었다. 실험에 앞서 원료분말인 Cr2O3와 환원제인 Mg, 희석제 NaCl을 섹션 3.2에 나타낸 열역학 계산을 통해 도 출한 화학양론 식을 아래 Eq. (1)에 나타내었으며 해당 몰 비로 칭량한 후 알루미나 볼을 사용하여 분쇄 및 혼합 공 정을 진행하였다. 혼합된 분말을 회수하여 Ø100mm, h 170 mm의 상대밀도 55.13%(상대밀도(g/cm3) = (이론밀도/ 겉보기 밀도)*100 = (1.61 / 2.92)*100)의 원통형 반응용기 에 충진하여 압분체를 제작하였다. 그 후 연소합성 반응이 일관되고 안정적으로 전달되게 하기 위해 점화기재로 TiC 와 PTFE 분말을 압분체 상단에 소량 장입하여 열전달 에 너지를 향상시켜 연소합성 반응을 진행하였다. 연소반응 후 생성물을 회수하여 25 μm 이하의 분말로 분쇄를 진행 하였고, 반응 부산물 제거를 위해 다양한 조건으로 산세공 정을 진행하였다. 그 후 Washing 및 80°C, 9 h 진공 분위 기에서 건조 후 최종 Cr 금속분말을 회수하였다. 최종적으 로 조건 별 회수된 Cr 분말을 SEM, XRD 등 다양한 분석 장비를 활용하여 물성평가 진행하였다.
- 2.3 분석 방법
- 본 연구를 통해 제조된 Cr 금속분말의 성분분석을 위해 Energy Dispersive Sepctroscopy(EDS) (Oxford, U.K사), Oxygen analysis(ELTRA GmbH사, Model: ONH 2000)을 활용하여 진행하였다. 또한, 구조분석은 Field Emission Scanning Electron Microscope(FE-SEM) (JEOL사, Model: JSM-7100F), X-Ray Diffractometer(XRD) (BRUKER AXS 사, Model: D8 ADVANCE), Micro Particle Size Analyzer (PSA) (Beckman Coulter Inc.사, Model: LS13 320 MW)을 활용하여 물성 평가를 진행하였다.
- 2.4 SHS Process 열역학 계산
- Cr2O3를 활용한 자전연소합성공정을 위해 환원제로 Mg 을 선택하여 환원제 몰수 별 생성물 및 단열합성온도 확 인을 위해 발열반응으로 Tig, Tad 수식을 활용하여 Cp값이 내장되어 있는 FactSage 8.0 프로그램의 Equilibriumreactants 모듈의 Cr2O3, Mg의 데이터 베이스를 활용하여 열역학적 계산을 진행하였다[14]. 열역학 계산 결과 및 고 찰은 섹션 3.2에 나타내었다.
2. Experimental
- 3.1 원료 및 혼합 분말 물성평가 결과
- 자전연소합성 공정 진행하기 전에 앞서 원료 분말인 Cr2O3, Mg과 혼합된 분말인 Cr2O3+Mg+NaCl 기초원료 분 석부터 수행하였다. Fig. 2에 나타낸 것처럼 본 연구에 사 용된 Cr2O3 분말의 FE-SEM 분석 결과, 구형에 가까운 조 대한 분말 주위에 3 μm 내외의 분말들이 응집된 형태로 관찰되었다.
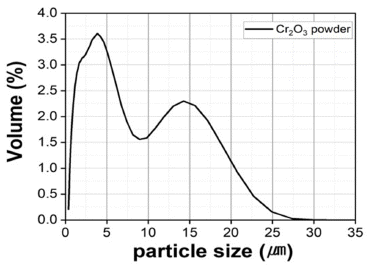
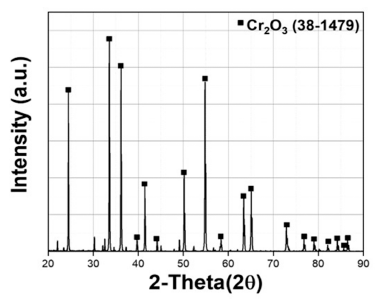
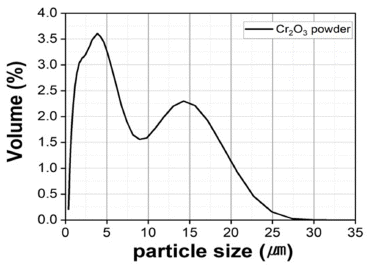
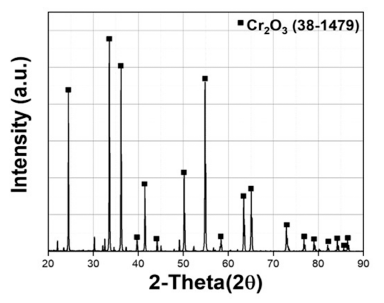
- 또한 Table 1에 나타낸 것처럼 EDS 분석 mapping 모듈 을 활용한 조성 분석 결과 Wt% 기준 O : 38.17%, Cr : 61.83%, At% 기준 O : 66.74%, Cr : 33.26%의 조성을 가진 분말임을 확인하였다. 마이크로입도분석기(PSA) 습식 모 듈을 활용한 Cr2O3 분말의 입도 분석 결과는 Fig. 3에 나 타내었으며 그 결과, FE-SEM 분석결과와 마찬가지로 조 대한 분말과 미세한 분말이 공존하는 Bi-Modal 형태이며, D10 0.89 μm, D50 3.26 μm, D90 13.94 μm 입도 사이즈를 가진 분말임을 확인하였다. 결정구조를 확인하기 위해서 XRD 분석을 실시하였고 Fig. 4에 나타낸 것 처럼 Cr2O3 결정상임을 확인하였다.
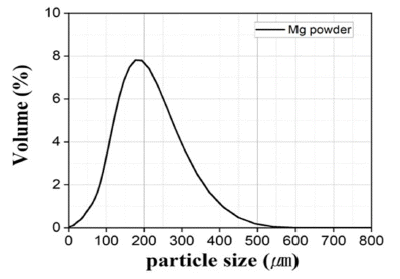
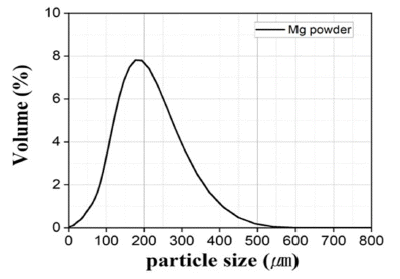
- 환원제로 사용되는 Mg 분말 FE-SEM 관찰 결과 육안상 불규칙한 판상형의 100 μm 이상의 조대한 분말로 분석되 었다. 이를 EDS의 Mapping 분석결과 일부 O가 존재하였 지만, 상대적으로 극미량으로 검출되어 Wt%, At% 모두 Mg 100%로 분석되었다. Mg은 Cr2O3에 비해 크기가 상대 적으로 조대하여 마이크로입도분석기(PSA) 건식 모듈을 활용하여 입도분석을 진행하였고, 그 결과 Mono-Modal 형태의 D50기준 175.8 μm로 분석되었다. 이를 각각 Fig. 5, Table 3, Fig. 6, Table 4에 나타내었다.
- 본 연구에 사용되는 Cr2O3, Mg, NaCl을 몰비대로 혼합 된 분말의 물성평가를 진행하였다. FE-SEM 및 EDS 분석 결과 조대한 Mg 및 NaCl 분말 주변에 상대적으로 미세한 Cr2O3 분말이 둘러 싸고 있는 형태로 존재함을 확인할 수 있었다. Fig. 7 및 Table 5에서 확인할 수 있듯이 Spectrum 1은 NaCl, Spectrum 2는 Cr2O3, Spectrum 3은 Mg 분말임 을 확인할 수 있다. Fig. 8 및 Table 6의 SEM, EDS Mapping 분석결과에서도 볼 수 있듯이, 조대한 분말 주변 에 미세한 Cr2O3 분말이 감싸고 있는 것을 확인할 수 있 다. Mg, NaCl 성분은 Cr2O3 성분에 비해 상대적으로 낮게 나와 분말 혼합이 매우 균질하게 이루어졌음을 확인할 수 있었다.
- 3.2 SHS Process 열역학 계산 결과
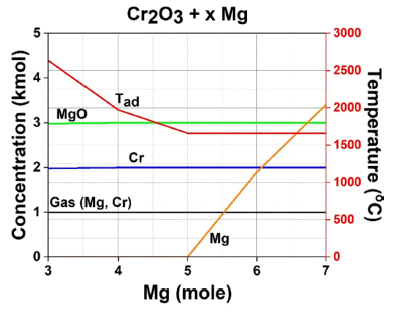
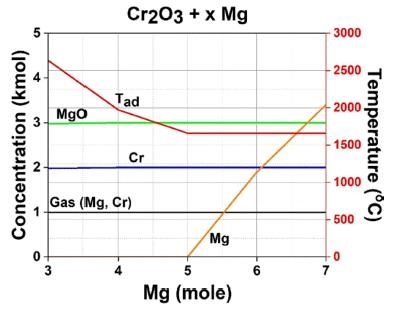
- 섹션 2.4에서 언급한 생성물 및 단열합성온도 확인을 위 한 열역학 계산 결과는 Fig. 9에 나타내었다. 그 결과 환 원제 Mg 몰수가 증가함에 따라 Cr, Mg, MgO외에 추가적 인 생성물이 확인되지는 않았다. 그러나, 5 mol 이상의 조 건에 경우 미 반응된 Mg이 잔존하기 때문에 4mol 이하 의 환원제가 사용되어야 한다고 판단하였다. 또한, 5 mol 이상의 Mg을 사용하면 Tad가 약 1,600°C까지 감소되나, Mg의 Boling point가 약 1,091°C이므로 잔여 Mg의 기화 가 일어나 입자 성장 억제 역할을 수행하지 못하여 입자 가 큰 Cr 분말이 제조됨을 시사할 수 있다. 따라서, 과량 의 Mg이 아닌 다른 희석제를 첨가하여 반응 온도 감소 및 입자 성장 억제가 필요하다고 판단하였다.
- 3~4 mol의 Mg을 사용 할 경우 2,000 – 2,700°C의 높은 반응 온도가 발생한다. 이는 Cr의 기화점인 2,672°C를 상 회하기 때문에 Cr의 휘발로 인한 회수율 감소 및 불안정 한 반응이 일어날 수 있다. 또한, 높은 합성온도로 인해 생 성물인 Cr의 입자 성장으로 인해 미세 구조 및 물성에 큰 영향을 줄 수 있다. 이러한 단점들을 개선하기 위해 희석 제 첨가가 필요하다고 판단되었으며, 물에 대한 용해성 이 360 g/L(25°C)으로 높고, 가격이 저렴한 NaCl을 선정 하였다.
- 3.3 산세 조건에 따른 Cr 분말 물성평가 결과
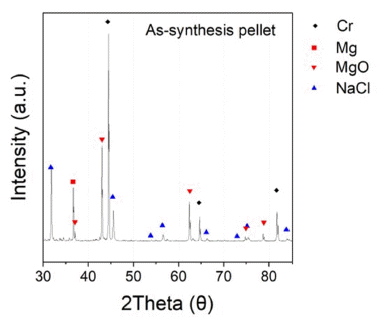
- 자전연소합성 후 생성물을 회수하여 XRD 분석을 진행 하였으며, 그 결과는 Fig. 10에 나타내었다. 그 결과 생성 물인 Cr, 반응 부산물인 Mg, MgO, NaCl의 결정상을 확인 하였다. 그리고 반응 부산물 제거를 통한 고순도의 Cr 분 말 회수를 위해 후처리 공정을 진행하였다.
- 생성물인 Cr과의 반응성은 없으며 반응 부산물인 Mg, MgO 제거를 위한 산세 조건[15]을 Table 7에 나타내었다. 조건 별 산세 공정 후 회수된 분말의 XRD 분석 결과는 Fig. 11에 나타내었다.
- 1번 조건을 제외한 모든 조건에서 반응 부산물이 제거 되었음을 확인하였고, 1번 조건에서는 제거되지 않은 미 량의 MgO가 남아있었다. 또한 모든 조건에서 미량의 MgCr2O4이라는 복합화합물이 생성됨을 확인하였다. MgO 가 제거되지 않은 이유와 MgCr2O4이라는 복합화합물이 생성된 이유는 다음과 같은 몇 가지 이유가 있을 수 있다.
- MgCr2O4의 형성 : MgCr2O4는 MgO와 Cr2O3가 존재하 는 고온에서 형성될 수 있는 안정한 화합물로[16], 산 세 공정시 MgO와 산과의 반응으로 인해 발생한 열이 Cr2O3와 MgO 사이의 반응이 발생하여 MgCr2O4가 형 성될 수 있음을 시사한다.
- 불순물의 존재 : 산세공정에 사용되는 시약 또는 실험 과정에서 생성될 수 있는 불순물 또는 기타 오염 물질 이 존재하면 반응을 방해하거나 최종 제품의 품질에도 영향을 미칠 수 있다.
- 결론적으로 Cr, MgO 및 NaCl의 혼합물에서 아세트산 및 질산을 사용하는 산세 공정 후 잔존 MgO 및 MgCr2O4 의 생성은 MgO와 Cr2O3의 반응, 불순물의 존재 등 여러 요인에 기인할 수 있다. 최종 제품의 원하는 특성을 확보 하기 위해서는 산 세척 공정을 최적화하여 위와 같은 요 소를 신중하게 고려하고 제어해야 한다.
- Table 7에 나타낸 산세 조건 중 XRD 분석 결과를 통해 반응 부산물의 제거 효율이 높고 비교적 짧은 공정 시간 이 요구되는 3번 조건(0.56 M CH3COOH / 1 h + 1.6 M HNO3 / 1 h)을 최적 조건으로 선정하였다. 해당 산세 조건 을 통한 후처리 공정 후 회수된 Cr 금속 분말의 물성을 평 가하고자 FE-SEM, EDS, PSA, XRF, Oxygen의 기초 분석 을 실시하였다. 먼저 FE-SEM 및 EDS 결과를 Fig. 12 및 Table 8에 나타내었다. Cr 분말의 형상은 원료 분말 Cr2O3 의 형상과 비슷하게 구형에 가까운 미세한 분말들이 응집 된 형태로 유지되었다. 이는 자전연소합성의 특징인 빠른 반응속도 및 고온으로 인해 분말 입자가 녹거나 변형될 시간이 충분하지 않고 고체 상태에서 반응이 발생되기 때 문이다[17-20]. 또한 이러한 연소합성의 특징은 분말 입자 의 조대화 또는 재형성으로 이루어질 수 있는 확산 공정 의 발생을 최소화할 수도 있다.
- EDS Point 분석결과를 보면 Wt% 기준 Cr이 94.64%로 Cr2O3에서 충분한 환원이 이루어졌음을 알 수 있다.
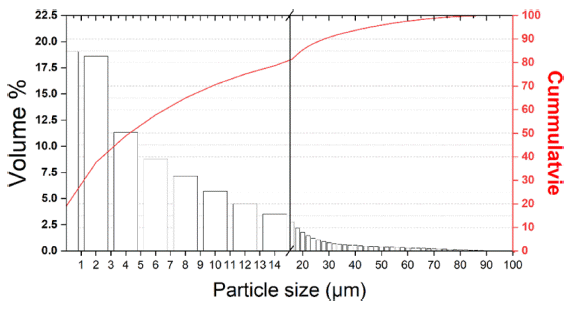
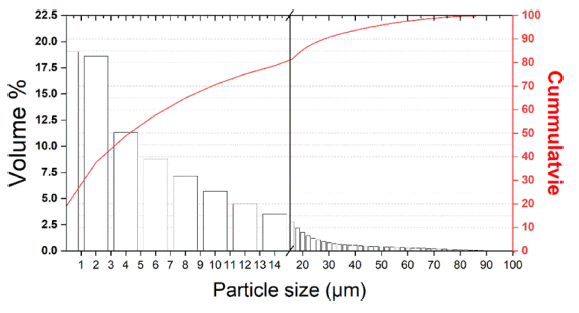
- 생성된 Cr 분말의 입자 크기 분포 분석을 위한 PSA 분 석기의 건식 모듈을 활용한 분석 결과는 Fig. 13 및 Table 9에 나타내었다. 그 결과, D50 6.22 μm, Mean size 11.83 μm 크기의 Cr 분말이 제조됨을 확인하였다.
- 제조된 크롬 분말의 성분 분석을 위한 XRF 및 Oxygen 분석 결과를 각각 Table 10과 Table 11에 나타내었다. XRF 분석기를 활용하여 제조한 Cr의 성분 분석 결과 98.95%로 분석되었으며, 산소 함량은 3회 측정 결과 평균 2.70%로 분석되었다.
3. Results and Discussion
Thermodynamic calculation results of product concentration and adiabatic synthesis temperature according to Mg mole fraction.
After the synthesis of Cr2O3 + 3Mg + 2NaCl, acid leaching conditions for removing reaction byproducts

|
(1) Results of XRD analysis immediately after SHS Process and XRD analysis after acid leaching by conditions (1) to (4).

- 본 연구에서는 자전연소합성법을 이용하여 고순도 Cr 분말 제조를 위해 열역학 계산을 통한 연소합성 공정 조 건 도출 및 다양한 산세 조건에 따른 물성 평가를 통해 고 순도 Cr 분말 제조 공정을 최적화하여 다음과 같은 결론 을 얻을 수 있었다.
열역학적 계산을 통해 최대합성온도가 2,700°C까지 상승할 수 있으므로 반응 온도 감소 및 입자 성장 억 제를 위한 희석제 첨가가 필요하다고 판단되어 최종 적으로 Cr2O3 + 3Mg + 2NaCl → 2Cr + 3MgO + 2NaCl 최적 연소 합성 공정 조건을 도출하였다.
다양한 산세 공정에 따른 Cr 물성 평가를 통해 최적 의 산세 공정 조건을 도출하였으며, 모든 조건에서 MgCr2O4 생성됨을 확인하였다. 이는 산세 공정 시 발 열반응으로 인해 잔여 Cr2O3와 MgO의 반응으로 생 성되었다고 판단된다. 따라서, 추가적인 연구를 통해 산세 공정 시 온도 제어를 통한 MgCr2O4 생성 억제 연구를 진행할 예정이다.
최종적으로 조건 별 제조된 Cr 분말을 다양한 분석 장비를 활용한 물성평가를 통해 미세한 구형 분말이 응집되고 다른 불순물이 제거된 Cr 분말이 제조됨을 확인하였다. 또한, XRF, Oxygen 분석 결과 Cr 성분 분석 결과 98.95%, 산소함량은 평균 2.7%를 가진 분 말이 제조됨을 확인하였다.
추가적인 연구를 통해 고순도 Cr 분말 내의 산소를 제거하기 위한 후처리 공정 최적화 관련 연구를 진행 할 예정이다.
4. Conclusion
-
Acknowledgements
- 이 연구는 2023년도 한국생산기술연구원(KITECH) 내 부 R&D 연구비(No. UR230010, 농업 폐 부산물 왕겨 활 용 반도체용 고순도 SiC 소재 제조 기술 개발) 및 한국산 업기술진흥원 R&D 연구비(No. P0021955, 반도체 공정 부산물 노광램프 내 텅스텐 폐기물(2ton/year) 재활용 기술 개발) 지원에 의한 연구임.
Acknowledgement
- 1. J. R. Davis: ASM international, J. R. Davis (Ed.), Printed in the United States of America, (2000) 584..ArticlePMC
- 2. S. E. P. Goncalves and E. Bresciani: Interfacial Phenom Heat Transf., (2017) 23..
- 3. S. Khara, S. Choudhary, S. Sangal and K. Mondal: Surf. Coat. Technol., 296 (2016) 203..Article
- 4. S. H. Chang, W. L. Chung and J. K. Chen: Int. J. Refract. Hard Met., 35 (2012) 70..Article
- 5. A. H. Sully and E. A. Brandes: Chromium, 2nd edn. Chap. 7., E. A. Brandes (Ed.), Butterworths, London, (1967)..
- 6. O. Hiroaki and T. B. Massalski: Binary Alloy Phase Diagrams, T. B. Massalski (Ed.), Materials Park, (1990) 138..
- 7. G. Z. Chen, E. Gordo and D. J. Fray: Metall. Mater. Trans. B, 35B (2004) 223..Article
- 8. T. Mori, J. Yang and M. K. Abara: ISIJ Int., 47 (2007) 1387..Article
- 9. N. M. Anacleto, I. Solheim, B. Sorensen, E. Ringdalen and O. Ostrovski: Reduction of chromium oxide and ore by methane-containing gas mixtures, R. T. Jones, P. den Hoed, and M. W. Erwee (Ed.), Cape Town, (2018) 71..
- 10. National Research Council: High-Purity Chromium Metal, W. D. Manly (Ed.), National Academy Press, Washington, D.C., (1995)..
- 11. J. Davies, D. Paktunc, J. J. Ramos-Hernandez, M. Tangstad, E. Ringdalen, J. P. Beukes, D. G. Bessarabov and S. P. Du Preez: Minerals., 12 (2022) 534..Article
- 12. Q. Zhao, C. Liu, B. Li, R. Ron Zevenhoven, H. Saxen and M. Jiang: Process Saf Environ Prot., 113 (2018) 78..Article
- 13. M. G. Kang, H. G. Lee and C. Lee: Appl. Surf. Sci., 254 (2008) 4066..
- 14. FactSage Software Ver 8.0. http://www.factsage.com/.
- 15. J. Jeřabkova, V. Tejnecky, L. Borůvka and O. Drabek: Sci. Agric. Bohem., 49 (2018) 297..
- 16. J. S. Park and H. G. Kim: J. Am. Ceram. Soc., 71 (1988) 173..Article
- 17. H. H. Nersisyan, H. S. Ryu, J. H. Lee, H. Y. Suh and H. I. Won: Combust. Flame., 219 (2020) 136..Article
- 18. H. H. Nersisyan, J. H. Lee, S. I. Lee and C. W. Won: Combust. Flame., 135 (2003) 539..Article
- 19. J. J. Sim, S. H. Choi, J. H. Park, I. K. Park, J. H. Lim and K. T. Park: J. Powder Mater., 25 (2018) 251..Article
- 20. Y. K, Lee, J. J. Sim, J. S. Byeon, Y. T. Lee, Y. W. Cho, H. C. Kim, S.G . Heo, K. A. Lee, S. J. Seo and K. T. Park: Arch. Metall. Mater., 66 (2021) 935..
Figure & Data
References
Citations



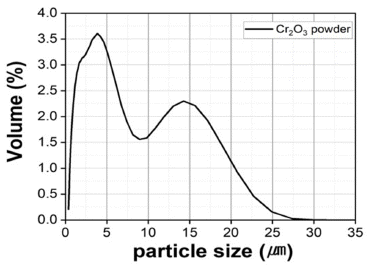


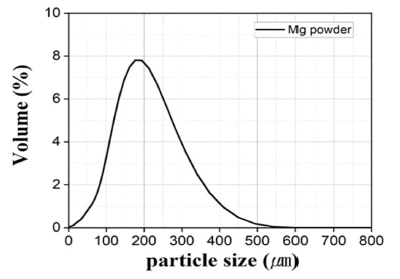


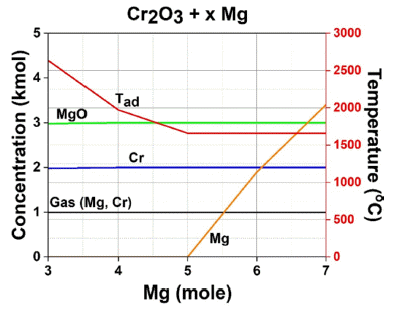

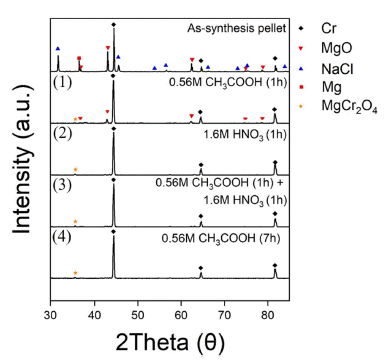

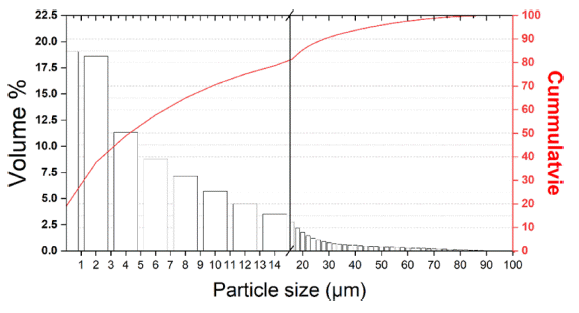
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
Fig. 9
Fig. 10
Fig. 11
Fig. 12
Fig. 13
Table 1
Table 2
Table 3
Table 4
Table 5
Table 6
Table 7
Table 8
Table 9
Table 10
Table 11
TOP
 KPMI
KPMI



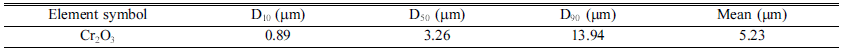


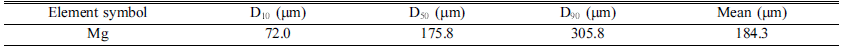










 Cite this Article
Cite this Article