Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 27(5); 2020 > Article
-
ARTICLE
전구체 농도에 따른 MoO3 나노 분말 합성 및 핵생성 거동 - 이세영, 권남훈, 노재석, 이근재*
- Synthesis and Nucleation Behavior of MoO3 Nano Particles with Concentration of Precursors
- Seyoung Lee, Namhun Kwon, Jaeseok Roh, Kun-Jae Lee*
-
Journal of Korean Powder Metallurgy Institute 2020;27(5):394-400.
DOI: https://doi.org/10.4150/KPMI.2020.27.5.394
Published online: September 30, 2020
단국대학교 에너지공학과
Department of Energy Engineering, Dankook University, Cheonan-si 311-16, Republic of Korea
- *Corresponding Author: Kun-Jae Lee, TEL: +82-41-550-3684, FAX: +82-41-559-7945, E-mail: kjlee@dankook.ac.kr
- - 이세영·권남훈·노재석: 학생, 이근재: 교수
• Received: September 23, 2020 • Revised: October 20, 2020 • Accepted: October 21, 2020
© The Korean Powder Metallurgy Institute. All rights reserved.
- 1,554 Views
- 8 Download
- 1 Crossref
Abstract
- Molybdenum trioxide (MoO3) is used in various applications including sensors, photocatalysts, and batteries owing to its excellent ionic conductivity and thermal properties. It can also be used as a precursor in the hydrogen reduction process to obtain molybdenum metals. Control of the parameters governing the MoO3 synthesis process is extremely important because the size and shape of MoO3 in the reduction process affect the shape, size, and crystallization of Mo metal. In this study, we fabricated MoO3 nanoparticles using a solution combustion synthesis (SCS) method that utilizes an organic additive, thereby controlling their morphology. The nucleation behavior and particle morphology were confirmed using ultraviolet-visible spectroscopy (UV-vis) and field emission scanning electron microscopy (FE-SEM). The concentration of the precursor (ammonium heptamolybdate tetrahydrate) was adjusted to be 0.1, 0.2, and 0.4 M. Depending on this concentration, different nucleation rates were obtained, thereby resulting in different particle morphologies.
- 몰리브데넘(Mo)은 우수한 열전도성, 내열성, 내마모성 및 내부식성의 특성을 가지는 고융점 금속으로, 전자, 항 공, 군수산업 및 석유화학 공업과 같은 다양한 분야에서 각광받는 주요 소재이다[1, 2]. Mo는 주로 페로몰리브덴 합금과 산화몰리브덴의 형태로 이용되며, 그 수요가 증가 함에 따라 Mo계 소재에 대한 관심이 나날이 높아지고 있 다[3]. 그중에서도 가장 대표적 Mo 산화물인 삼산화몰리 브덴(MoO3)은 우수한 이온 전도성 및 열적 물성으로 센서, 광촉매, 디스플레이 장치, 유기 태양전지(Organic Photovoltaics, OPV) 및 리튬이온 배터리 등에 광범위하게 활용 된다[4-8]. 또한 나노 스케일의 MoO3는 구조적·광학적으 로 독특한 특성을 지녀 MoO3 나노입자 합성 공정에 대한 많은 연구들이 진행되고 있다[9].
- 몰리브데넘 금속은 대부분 텅스텐과 구리 광석의 부산 물로서 얻어지기 때문에 정제와 환원 과정이 필수적이다 [10]. 순수 Mo 금속은 일반적으로 MoO3로부터 수소 환원 과정을 거쳐 얻어지며 이산화몰리브덴(MoO2)과 같은 중 간 산화물을 거친다[11]. 또한 MoO3의 환원 공정은 Mo 입자의 형상, 크기 및 결정성 등에 영향을 미친다. 특히 산 화물 고유의 특성에 따라 최종적으로 얻어지는 몰리브데 넘 금속의 물성이 결정되기 때문에 MoO3 합성 공정에서 의 제어가 매우 중요하다.
- 이러한 MoO3는 합성 방법 및 조건에 따라 구형, 막대 형, 판형, 벨트형 등의 다양한 형상으로 성장시킬 수 있다 [12-14]. MoO3를 제조하기 위한 공정으로는 수열합성법 (Hydrothermal synthesis)[15], 용매열합성법(solvothermal method)[16], 화학증기수송법(Chemical vapor transport, CVT)[17], 스핀코팅(spin coating)[18], 졸겔법(sol-gel process) [19], 용액연소합성법(solution combustion synthesis)[20] 등이 알려져 있다. 이러한 공정들은 대부분 공정 과정이 복잡하고 높은 공정 비용이 요구되어 산업적으로 활용하 기에 한계가 있다. 하지만 이 중에서도 용액연소합성법은 오토클레이브(autoclave)와 같은 고가의 장비 사용 없이 간단한 공정과 낮은 공정비용으로 미세한 나노입자의 합 성이 가능하다는 장점이 있다[21].
- 본 연구에서는 용액연소합성 방법을 이용하여 안정상의 MoO3 나노입자를 제조하고자 하였다. 또한 용매 중 전구 체((NH4)6Mo7O24 ·4H2O, ammonium heptamolybdate tetrahydrate) 의 농도가 나노입자의 핵생성 거동에 미치는 영향을 분석하여 반응 시간에 따른 미세구조의 변화를 알아보았 다. 또한 MoO3 특성 제어를 통해 향후 Mo 금속의 다양한 활용 목적에 적합한 전구체 합성 조건을 설정하는 데에 기여하고자 하였다.
1. 서 론
- 2.1 전구체 농도에 따른 핵생성 거동 및 MoO3 나노입자 합성 실험
- MoO3 나노입자의 합성 전구체로는 ammonium heptamolybdate tetrahydrate(JUNSEI, 99.0%)를 사용하였 고, 유기 첨가제로 urea(JUNSEI, 99.0%)를 사용하였다. D.I water를 용매로 이용하였으며, acetic acid(DAEJUNG, 99.7%)로 용액의 pH를 조절하였다.
- 전구체 농도에 따른 입자 핵생성 거동을 알아보기 위하 여 AHM을 D.I water에 각각 0.1 M, 0.2 M, 0.4 M이 되도 록 첨가한 후 상온에서 교반하여 용해시켰다. 준비된 AHM 수용액에 동일한 방법과 농도로 제조한 urea 수용액 을 첨가하고, 혼합된 용액에 acetic acid를 첨가하여 pH 3 으로 조절하였다. 이 용액은 Hot-plate에서 85°C, 200 rpm 으로 2시간 교반하여 흰색의 침전물이 형성되도록 한 후 90°C 오븐에서 9시간 이상 충분히 건조하여 침전 분말을 회수하였다. 회수된 분말은 사용된 유기 첨가제 및 불순물 제거를 위해 250°C에서 1시간 동안 열처리하였으며, 안정 상의 MoO3 형성을 위해 550°C에서 9 0분간 2차 열처리를 진행하였다.
- 2.2 특성 평가
- 반응 공정에서 5분 간격으로 Ultraviolet-visible spectroscopy( UV-1800, SHIMADZU) 분석을 진행하여 나노입자의 핵생성 거동을 파악하였고, Dynamic light scattering(DLS, NanoPlus-3, Otsuka Electronics)을 사용하여 형성된 침전 물의 입도 분포를 알아보았다. 침전 분말의 상분석 및 MoO3 형성 여부는 Xray diffractometer(XRD, ULTIMA IV, Rigaku)에 의해 확인되었다. 또한 Field Emission Scanning Electron Microscope(FE-SEM, SIGMA 500, CARL ZEISS)를 통해 침전 분말과 MoO3 입자의 형상 및 크기를 확인하였다.
2. 실험 방법
- 3.1 전구체 농도에 따른 핵생성 거동
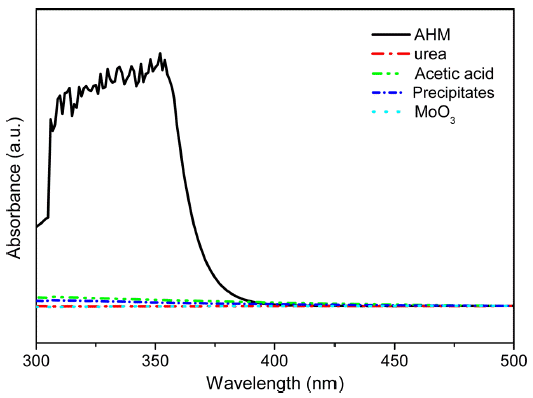
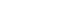
- 전구체로 사용한 AHM은 그림 1과 같은 형태로 존재한 다[20]. [Mo7O24]6- 염의 가장자리에 존재하는 6개의 Mo 원자 말단에는 두 개의 Mo=O 결합이 형성되어 있다. AHM 분자에 자외선을 조사하게 되면 Mo=O 말단에서 리 간드-금속 전하 전이(LMCT)가 발생하게 되고, 이러한 부 분적 환원의 결과로 그림 2의 AHM UV-vis 데이터와 같 이 자외선 파장대에서 흡광도 피크가 나타난다[22].
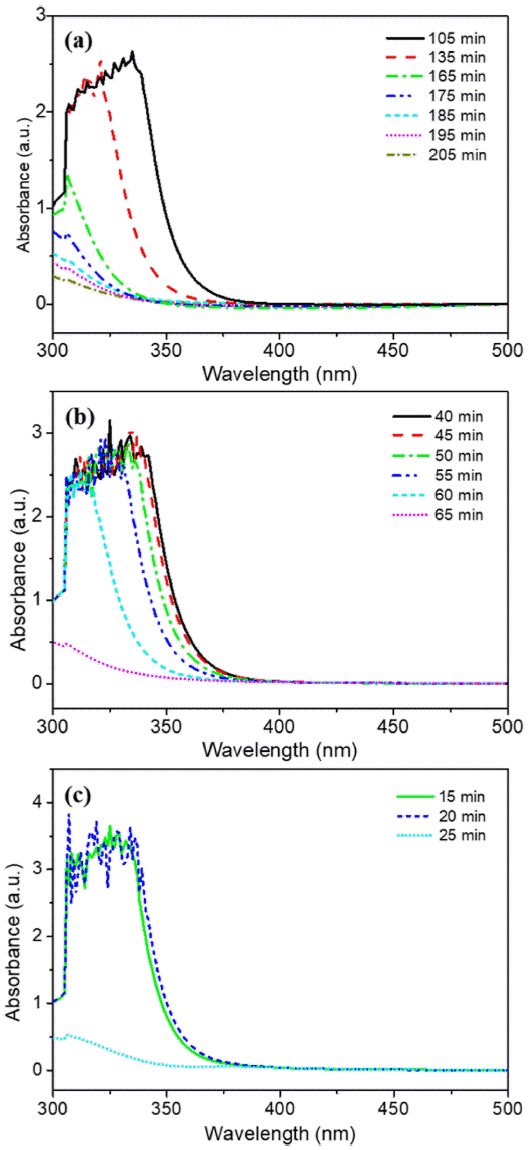
- 그림 3(a)-(c)는 각 전구체 농도 별 UV-vis 분석 결과를 반응 시간에 따라 나타낸 그래프이다. UV-vis 분석은 85°C로 승온된 시점으로부터 5분 간격으로 진행되었으며 분석에 사용된 용액은 추출 후 syringe filter를 통해 여과 후 D.I water로 희석되었다. 또한 그림 3(a)-(c)에서 공통적 으로 나타나는 특정 파장대에서의 흡광도 감소 경향에 대 해 알아보기 위하여 본 실험에 사용된 분말 및 용액과 반 응 과정에서 합성된 침전물, 그리고 최종 열처리 이후 형 성된 MoO3 분말의 UV-vis 분석을 진행하였다. 그림 2를 그림 3(a)-(c)의 그래프와 비교해 보면 반응이 진행됨에 따 라 전구체로 사용된 AHM의 농도가 전체적으로 감소하였 음을 알 수 있다. 전구체 농도의 변화를 비교하는 데 있어, 분석 장비의 한계로 AHM의 흡광도 피크들이 불규칙적으 로 치솟는 경우가 존재하여 이를 보다 명확히 비교하기 위해 5분 단위로 나타낸 UV-vis 그래프의 폭을 계산하였 다. 폭은 흡광도 피크가 상승하는 구간의 Y축 중간 지점 과 다시 낮은 영역대로 감소하는 부분의 파장 차이를 기 준으로 하였다. 이를 통해 전체적으로 비교해 본 결과 침 전물 형성 단계 이전에는 폭이 약 5~10 nm 간격으로 미세 하게 감소하였으며 반응이 원활하게 진행되면서 약 30~50 nm 차이로 폭이 대폭 감소함을 확인하였다.
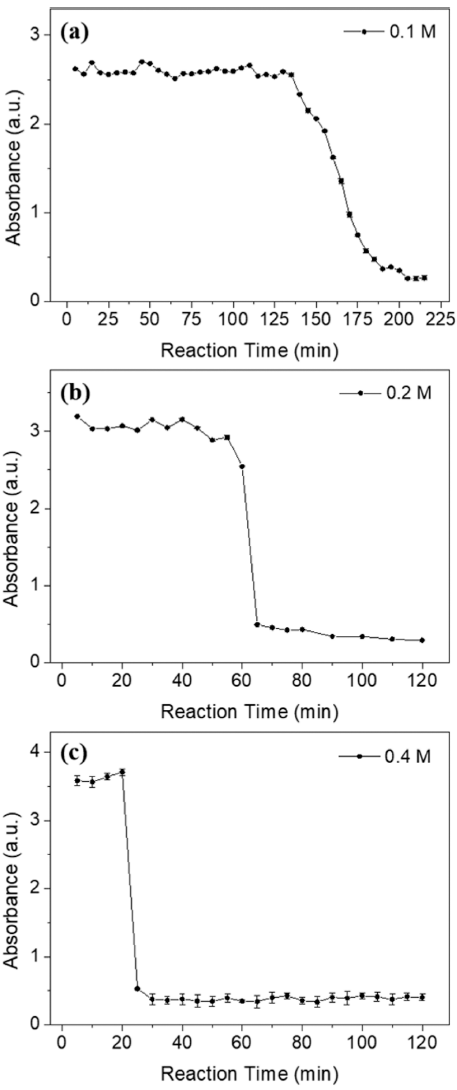
- AHM 농도의 감소 경향을 통해 전구체 농도 조건에 따 른 반응 종료 시점을 파악하였다. 그림 4(a)-(c)는 5분 간 격으로 측정한 UV-vis 분석 데이터를 바탕으로 흡광도 피 크의 최댓값을 반응 시간에 따라 도식한 그래프이다. 0.1 M 반응 용액에서는 2시간 동안 반응시켰을 때 다른 조건들에 비하여 침전물의 형성이 원활하게 이루어지지 않았다. 따라서 반응 종료 시간을 확인하기 위하여 별도로 215분까지 반응 시간을 연장하여 분석하였으며, 이는 낮 은 전구체 농도로 인한 이온 반응성 감소에 따른 현상으 로 판단된다. 그림 4(a)에서 보듯이 0.1 M AHM 수용액으 로 제조한 반응 용액 경우 약 135분 이후 꾸준히 농도가 감소하였으며 반응 시작 약 205분 후에 반응이 종료되었 다. 0.2 M 및 0.4 M 용액의 반응 종료 시점은 그림 4(b), (c)에서 보이는 바와 같이 각각 65분, 25분 후로 나타났다. 즉, AHM의 농도가 높을수록 반응이 단시간에 급격히 진 행되었는데, 이는 반응 용액이 과포화도에 빠르게 도달하여 핵생성 및 침전의 진행 시간이 단축된 것으로 예상된다.
- 핵생성 속도에 따른 입자의 미세구조를 비교하기 위해 FE-SEM 분석을 진행하여 그림 5(a)-(c)에 나타내었다. 0.1 M AHM 용액으로 형성시킨 침전물은 각진 모서리를 가진 판형의 형상을 보이며, 0.2 M의 경우 비교적 매끄럽 고 둥근 형태의 판형 입자들이 생성되었다. 이는 핵생성이 비교적 빠르게 진행된 0.2 M 반응 용액에서 입자의 표면 에너지를 감소시키기 위하여 Ostwald ripening이 진행되었 고, 비교적 작은 입자들이 큰 입자에 증착하면서 둥근 형 태로 성장한 것으로 사료된다. 이러한 성장 메커니즘에 따 라 0.2 M 조건에서의 입자 크기가 0.1M에 비해 크게 형 성되었음을 유추할 수 있다. 또한 0.4M 반응 용액에서 획 득한 침전물의 경우 핵생성 단계가 빠르게 종료되고 Ostwald ripening이 진행 중에 있음을 예상할 수 있으며, 이에 따라 입자가 불균일한 형상으로 확인된다.
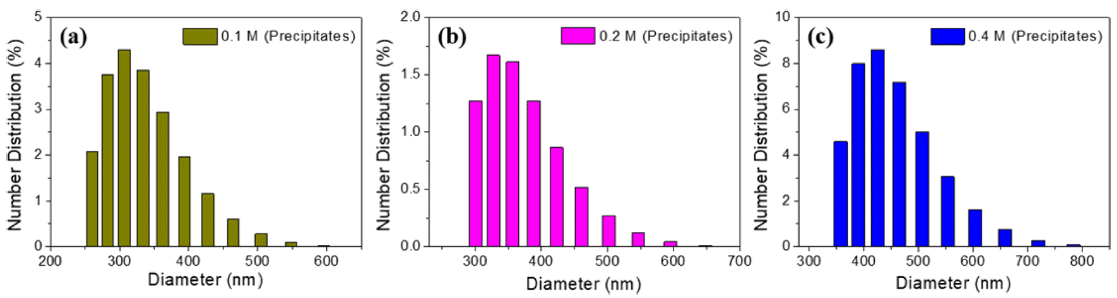
- 앞서 예상한 입자 크기의 경향성을 확인하기 위하여 각 조건에 따라 형성된 침전물을 수득하여 입도를 분석하였 다. 그림 6(a)에서 보듯이 0.1M 용액의 침전물은 260~ 595 nm의 입도 범위를 가지며 307 nm 크기의 입자들이 주로 존재하고 있었다. 또한 0.2M 용액의 침전물은 300~ 650 nm 범위의 입도 분포를 보이고 그 중에서도 328 nm 의 입자들이 주로 존재함을 그림 6(b)를 통해 확인하였다. 가장 큰 입도를 가질 것으로 예상했던 0.4 M 용액에서의 침전물은 그림 6(c)에서 보이는 바와 같이 357~785 nm 크 기로 존재하며 대부분의 입자는 426 nm 크기를 나타내었 다. 위 결과와 UV-vis 및 FE-SEM 분석 데이터를 종합해 보았을 때, 전구체 용액이 고농도일수록 핵생성 종료 시점 이 단축됨으로 인해 입자가 성장할 시간이 확보되었고, 이 에 따라 침전 분말의 입자가 비교적 큰 입도로 존재하는 것으로 이해할 수 있다.
- 3.2 MoO3 나노입자 합성
- 용액연소합성법에 의한 MoO3의 합성 과정은 다음과 같 은 화학반응을 통하여 이루어진다[23].
- 위 반응식에 따르면 유기 첨가제를 사용하지 않고도 AHM의 열처리 과정을 통해 MoO3 합성이 가능하다. 그럼 에도 불구하고 urea(CO(NH2)2)를 유기 첨가제로 사용하는 이유는 첨가제가 MoO3의 핵생성 및 성장을 용이하게 하 기 때문이다. Urea에 존재하는 질소의 비공유 전자쌍은 AHM의 중심에 위치한 Mo6+ 이온과의 강한 상호작용을 통해 새로운 리간드 구조를 형성함으로써 핵생성을 유도 한다[24]. 이러한 유기물들은 반응 종료 이후 두 번의 열 처리 과정을 통해 제거된다.
- 그림 7은 회수한 침전 분말과 열처리 과정을 거쳐 형성 된 MoO3 분말의 XRD 분석 결과이다. 그림 7(a)에서 보듯 이 열처리 과정 이전의 침전 분말은 부분적으로 AHM의 XRD 패턴과 대응되나 농도 조건에 따라 조금씩 다르게 나타나며 다량의 유기물이 혼재되어 있어 명확한 상을 파 악하는 데에 어려움이 있었다. 따라서 잔존하는 유기물 및 수분의 제거를 위해 침전 분말을 250°C에서 1차적으로 열 처리하였다. 또한 MoO3는 350°C 이상의 온도에서 형성되 는 것으로 보고된 바 있어 이를 바탕으로 550°C 온도 조 건에서 한 번 더 열처리하였다[25]. 최종 열처리 과정을 거친 분말은 푸른빛을 띠는 회색을 나타냈으며, 그림 7(b) 의 XRD 분석 결과로부터 남아있던 유기물이 완전히 산화 되고 안정상의 MoO3가 형성되었음을 확인하였다.
- 이와 같이 합성한 MoO3 입자의 미세구조는 그림 5에 나타난 침전물의 형상에 따라 차이를 보일 것으로 예상되 어 FE-SEM 분석을 통해 관찰하였다. 그림 8(a)-(c)는 각각 0.1 M, 0.2 M, 0.4 M 농도의 전구체 용액으로부터 수득한 침전물을 열처리하여 얻은 MoO3 입자의 형상이다. 0.1 M 의 저농도 조건에서 합성한 MoO3 입자는 주로 얇고 긴 타원형의 판 형태로 존재하였다. 이에 반해 그림 8(b)와 (c)의 경우에는 그림 8(a)에 비해 원형의 입자들이 주로 관 찰되었다. 불규칙한 형상의 0.4M 침전물로부터 합성된 MoO3는 역시 불규칙하고 다양한 형상을 보였다. 입자의 평균 두께는 0.1M에서 56.8 nm, 0.2M에서 68 nm, 0.4M 의 경우 121 nm로, 고농도 조건일수록 두께가 두껍게 형 성되어 있었다. 이상의 결과를 통해 AHM이 저농도로 존 재할수록 그에 따라 형성되는 MoO3 입자의 두께가 감소 하여 층층이 겹쳐진 판형의 형태로 나타난 것으로 예상된 다. 또한 이렇게 제조한 MoO3의 미세구조는 침전물 입자 의 형상에 영향을 받는 것으로 사료된다.
- MoO3의 입도 분포는 설정한 농도 조건에 따라 분석하 여 그림 9(a)-(c)에 나타내었다. 0.1 M, 0.2 M 및 0.4M 용 액으로부터 합성한 MoO3 입자는 각각 230~525 nm, 265~ 745 nm, 272~740 nm의 입도 분포를 보인다. 가장 높은 비 율로 존재하는 입도는 각각 250 nm, 289nm , 343 nm로, AHM의 농도가 증가할수록 그로부터 형성된 MoO3 입자 의 크기 또한 증가한 것으로 확인되었다. MoO3의 농도 별 입도 분포는 앞서 서술했던 그림 6(a)-(c)의 침전물 입도와 유사한 경향을 보이며, 열처리 과정을 통한 유기물 제거로 인해 전체적인 입자 크기가 감소한 것으로 판단된다.
3. 결과 및 고찰
Fig. 3

UV-vis data according to reaction t ime of (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M AHM solutions.

Fig. 4

Variation of absorbance by reaction time according to AHM concentrations in (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M.

Fig. 6

The results of size analysis with precipitates formed by (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M AHM solution.

Fig. 7

XRD results of (a) precipitates and (b) obtained MoO3 powder by concentration of AHM in solution.

- 본 연구에서는 용액연소합성 공정을 이용하여 MoO3 나 노입자를 제조하고 합성 전구체로 사용한 ammonium heptamolybdate tetrahydrate(AHM)의 용매 중 농도에 따른 입자의 핵생성 거동 및 미세구조 차이를 분석하였다. AHM의 농도 조건은 0.1M, 0.2M, 0.4M로 설정하였으며, 고농도로 조절할수록 핵생성이 빠르게 진행됨을 확인하였 다. 이에 따른 입자의 특성 변화를 알아보기 위하여 반응 과정에서 형성된 침전물과 최종적으로 제조한 MoO3의 형 상 및 입도 분포를 각 농도 조건에 따라 분석하였다. 0.1 M 및 0.2M 용액에서 형성된 침전물은 모두 판형으로 관찰되었으나 0.2M의 경우 Ostwald ripening에 의해 전체 적으로 둥근 형상으로 나타났다. 침전 분말의 열처리 과정 을 통해 합성한 MoO3 입자는 0.1M 농도 조건에서 타원 형의 얇은 판 형태로 관찰되고, 0.2 M 조건에서는 비교적 두꺼운 원형 입자들이 주로 확인되었다. 0.4 M 용액의 경 우에는 반응 시간이 단축됨에 따라 침전물과 MoO3 모두 입자 형상이 불규칙하게 관찰되었다. 전구체의 농도가 증 가할수록 침전 분말의 입도 또한 증가하는 경향을 보였는 데 이는 핵생성 속도에 따른 입자 성장 시간의 차이로 이 해할 수 있으며, MoO3의 입도 분포 또한 유사한 경향을 보임을 확인하였다. 본 연구는 향후 MoO3의 합성과 몰리 브데넘 금속으로의 환원 공정에 대한 연구에 기초 자료로 이용될 수 있을 것으로 기대된다.
4. 결 론
-
Acknowledgements
- 이 연구는 2020년도 산업통상자원부 및 산업기술평가관 리원 (KEIT) 연구비 지원에 의한 연구임 ('No. R-2020- 00777')
감사의 글
- 1. M. S. Park, Y. D. Kim, J. P. Park and S. D. Choi: Trends Met. Mater. Eng., 21 (2008) 15. .
- 2. Y. M. Kim, E. P. Kim, S. Lee and J. W. Noh: J. Korean Powder Metall. Inst., 14 (2007) 221. .Article
- 3. B. S. Kim, J. S Sohn, J. C. Lee and H. S. Jeon: Trends Met. Mater. Eng., 21 (2008) 20. .
- 4. X. Zhao, M. Cao and C. Hu: Mater. Res. Bull., 48 (2013) 2289. .Article
- 5. N. Rajiv Chandar, S. Agilan, R. Thangarasu, N. Muthukumarasamy and R. Ganesh: J. Mater. Sci. Mater. Electron., 10 (2020). .
- 6. A. Chithambararaj, N. S. Sanjini, S. Velmathib and A. Chandra Bose: Phys. Chem. Chem. Phys., 15 (2013) 14761. .ArticlePubMed
- 7. R. Shoda, E. Kitazume and S. Kaneta: United States, US 7872413 (2011). .
- 8. M. B. Upama, M. Wright, N. K. Elumalai, M. A. Mahmud, D. Wang, K. H. Chan, C. Xu, F. Haque and A. Uddin: Curr. Appl. Phys., 17 (2017) 298. .Article
- 9. A. Chithambararaj and A. C. Bose: J. Alloys Compd., 509 (2011) 8105. .Article
- 10. J. H. Lee, I. J. Kim and B. C. Kim: Econ. Environ. Geol., 40 (2007) 503. .
- 11. M. Saghafi, S. Heshmati-Manesh and A. Ataie: Int. J. Refract. Met. Hard Mater., 30 (2012) 128. .Article
- 12. D. Zhao, X. Zhang, H. Huan, X, Dong, H. Zhu, Z. Li, Y. Qi, J. Hu and X. Zeng: Mater. Lett., 256 (2019) 126648. .Article
- 13. M. Abboudi, H. O. Hassani, F. A. Wadaani, S. Rakass, A. A. Ghamdi and M. Messali: J. Taibah Univ. Sci., 12 (2018) 133. .Article
- 14. H. C. Xuan, Y. Q. Zhang, Y. K. Xu, H. Li, P. D. Han, D. H. Wang and Y. W. Du: Phys. Status Solidi A, 213 (2016) 2468. .Article
- 15. X. W. Lou and H. C. Zeng: Chem. Mater., 14 (2002) 4781. .Article
- 16. W. S. Kim, H. C. Kim and S. H. Hong: J. Nanopart. Res., 12 (2010) 1889. .Article
- 17. Y. J. Lee, W. T. Nichols, D. G. Kim and Y. D. Kim: J. Phys. D: Appl. Phys., 42 (2009) 115419. .Article
- 18. M. Balaji, J. Chandrasekaran and M. Raja: Optik, 127 (2016) 6015. .Article
- 19. L. P. Babu Reddy, H. G. Rajprakash, and Y. T. Ravikiran: AIP Conf. Proc., 2142 (2019) 070022. .Article
- 20. D. Parviz, M. Kazemeini and A. M. Rashidi: J. Nanopart. Res., 12 (2010) 1509. .Article
- 21. G. P. Nagabhushana, D. Samrat and G. T. Chandrappa: RSC Adv., 4 (2014) 56784. .Article
- 22. M. D. Ward, J. F. Brazdil and R. K. Grasselli: J. Phys. Chem., 88 (1984) 4210. .Article
- 23. N. Desai, S. Mali, V. Kondalkar, R. l. Mane, C. Hong and P. Bhosale: J. Nanomed. Nanotechnol., 6 (2015) 1000338. .Article
- 24. D. Parviz, M. Kazemeini, A. M. Rashidi and K. J. Jozani: Sci. Iran., 18 (2011) 479. .Article
- 25. M. Epifani, P. Imperatori, L. Mirenghi, M. Schioppa and P. Siciliano: Chem. Mater., 16 (2004) 5495. .Article
Figure & Data
References
Citations
Citations to this article as recorded by 

- Characterization of Compacted and Pressureless Sintered Parts for Molybdenum Oxide Powder according to Hydrogen Reduction Temperature
Jong Hoon Lee, Kun-Jae Lee
Journal of Powder Materials.2024; 31(4): 336. CrossRef
Synthesis and Nucleation Behavior of MoO3 Nano Particles with Concentration of Precursors
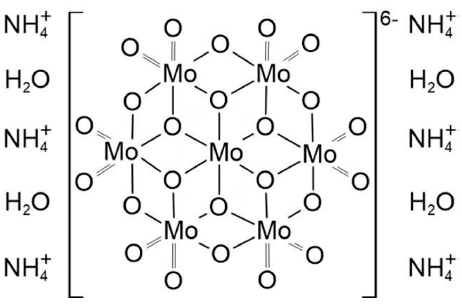

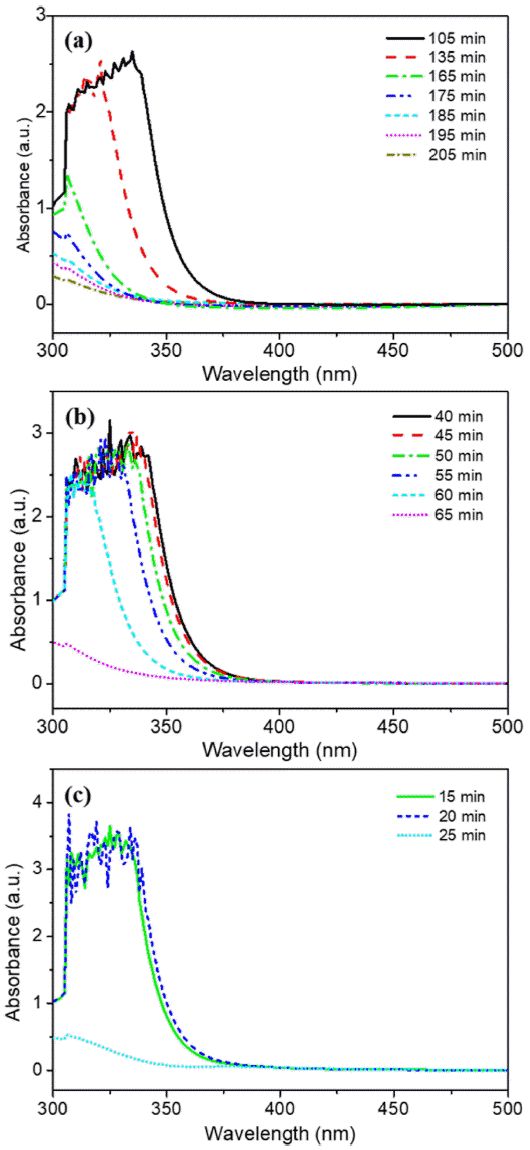
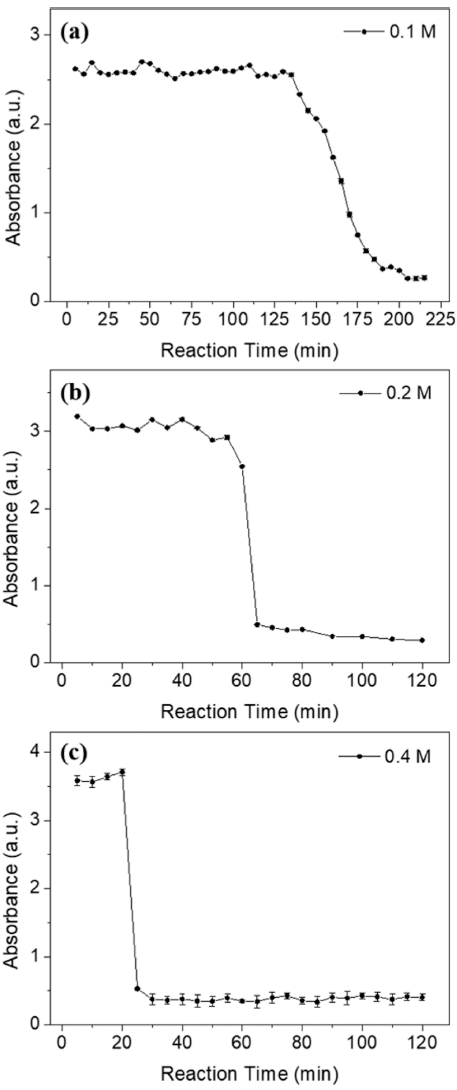

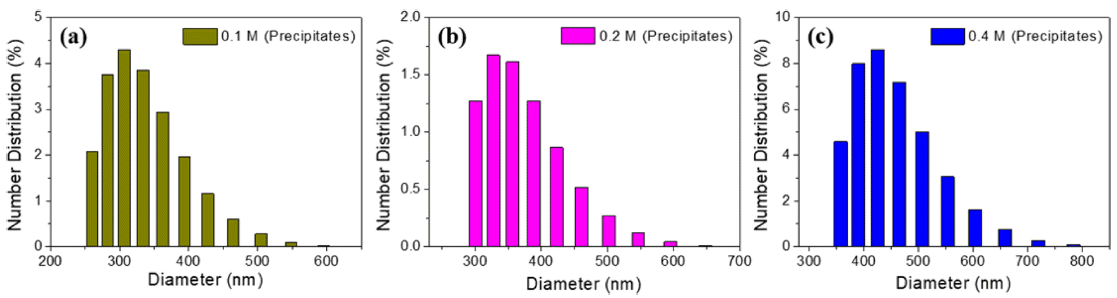



Fig. 1
The structure of ammonium heptamolybdate tetrahydrate (AHM) molecule.
Fig. 2
UV-vis result of AHM, urea, acetic acid, precipitates and MoO3.
Fig. 3
UV-vis data according to reaction t ime of (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M AHM solutions.
Fig. 4
Variation of absorbance by reaction time according to AHM concentrations in (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M.
Fig. 5
SEM images of precipitates formed by (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M AHM solution.
Fig. 6
The results of size analysis with precipitates formed by (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M AHM solution.
Fig. 7
XRD results of (a) precipitates and (b) obtained MoO3 powder by concentration of AHM in solution.
Fig. 8
SEM images of MoO3 synthesized by (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M AHM solution.
Fig. 9
Size analysis of synthesized MoO3 from different AHM solution, (a) 0.1 M, (b) 0.2 M, and (c) 0.4 M.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
Fig. 9
Synthesis and Nucleation Behavior of MoO3 Nano Particles with Concentration of Precursors
TOP
 KPMI
KPMI






 Cite this Article
Cite this Article