Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 26(1); 2019 > Article
-
ARTICLE
염 보조 초음파 분무 열분해법을 이용한 TiO2 나노입자의 합성 및 광학적 성질 - 지명준, 박우영, 유재현, 이영인*
- Synthesis and Optical Property of TiO2 Nanoparticles Using a Salt-assisted Ultrasonic Spray Pyrolysis Process
- Myeong-Jun Ji, Woo-Young Park, Jae-Hyun Yoo, Young-In Lee*
-
Journal of Korean Powder Metallurgy Institute 2019;26(1):34-39.
DOI: https://doi.org/10.4150/KPMI.2019.26.1.34
Published online: January 31, 2019
서울과학기술대학교 신소재공학과
Department of Materials Science and Engineering, Seoul National University of Science and Technology, Seoul 01811, Republic of Korea
- *Corresponding Author: Young-in Lee, TEL: +82-2-970-6646, FAX: +82-973-6657, E-mail: youngin@seoultech.ac.kr
- - 지명준: 학생, 박우영: 학생, 유재현: 학생, 이영인: 교수
• Received: January 31, 2019 • Revised: February 21, 2019 • Accepted: February 22, 2019
© The Korean Powder Metallurgy Institute. All rights reserved.
- 844 Views
- 1 Download
- 1 Crossref
Abstract
- Current synthesis processes for titanium dioxide (TiO2) nanoparticles require expensive precursors or templates as well as complex steps and long reaction times. In addition, these processes produce highly agglomerated nanoparticles. In this study, we demonstrate a simple and continuous approach to synthesize TiO2 nanoparticles by a salt-assisted ultrasonic spray pyrolysis method. We also investigate the effect of salt content in a precursor solution on the morphology and size of synthesized products. The synthesized TiO2 nanoparticles are systematically characterized by X-ray diffraction, transmission electron micrograph, and UV-Vis spectroscopy. These nanoparticles appear to have a single anatase phase and a uniform particle-size distribution with an average particle size of approximately 10 nm. By extrapolating the plots of the transformed Kubelka-Munk function versus the absorbed light energy, we determine that the energy band gap of the synthesized TiO2 nanoparticles is 3.25 eV.
- 이산화티타늄(titanium dioxide, titania, TiO2)은 우수한 화학적 및 열적 안정성을 가지고 있으며, 높은 굴절률 및 유전상수와 광촉매 효율을 가지고 있기 때문에, 안료, 센 서, 배터리, 고굴절 필름 및 촉매 분야에서 광범위하게 사 용되고 있다[1-3]. TiO2가 적용되는 대부분의 응용분야에 서 TiO2의 비표면적(specific surface area)은 성능을 결정 하는 주요한 요소로 간주된다. 예를 들면, TiO2를 광촉매 로 활용하여 대기질 및 수질 개선을 시도하는 경우, 광촉 매 반응이 진행되기 위해서는 우선적으로 오염물질이 TiO2 표면에 흡착되어야 하며, 흡착되는 오염물질의 양은 TiO2의 비표면적에 의해 좌우되고 이는 오염물질의 제거 효율에 큰 영향을 미치게 된다. 일반적으로 소재의 비표면 적은 크기와 형상에 의해 좌우되며, 나노미터 수준의 크기 를 갖는 다양한 형상의 입자에 대한 합성 및 응용 연구가 활발히 이뤄지고 있다[4-6].
- 일반적으로 TiO2 나노입자는 졸-겔법(sol-gel method), 수열 합성법(hydrothermal method) 또는 용매열 합성법 (solvothermal method)과 같은 습식 기반 공정을 이용해 합 성된다[7-9.]. 하지만 졸-겔법은 가수분해 및 응축반응을 통해 형성된 생성물을 열처리하여 나노입자를 제조하기 때문에, 미세한 입자를 구현하기가 어렵고, 결정성을 확보 하기 위해 고온에서의 열처리가 요구되며 이 과정에서 입 자의 성장 및 강한 응집이 필연적으로 발생되는 문제점을 가지고 있다. 수열 및 용매열 합성법의 경우, 상대적으로 낮은 온도에서 합성이 진행되지만, 용매에 용해된 이온의 충돌에 의해 핵생성을 유도하기 때문에 분말의 크기 및 형상을 제어하기 위해서는 전구체 농도를 낮은 수준으로 유지해야 한다. 또한 제조 가능한 분말의 양이 반응기의 크기에 의존하는 배치(batch)형 공정이기 때문에, 연속생 산 및 대량생산에 한계를 가지고 있다.
- 전술한 습식 기반 공정과 달리, 초음파 분무 열분해법 (Ultrasonic spray pyrolysis, USP)은 전구체 용액에 초음파 를 인가하여 수 백 나노미터 또는 수 마이크로미터 수준 의 액적(droplet)을 형성하고, 이를 운반 또는 반응 가스를 이용해 관상로(tube furnace) 내부로 이송한 후, 적절한 온 도에서 순간적으로 용매의 증발과 전구체의 분해 및 결정 화를 유도해 다양한 금속 및 세라믹 분말을 합성하는 기 상 공정 중 하나이다[10-12]. USP 공정은 용액 상태의 출 발 물질을 이용하기 때문에 수용액 기반의 다양한 전구체 를 활용할 수 있다는 장점이 있다. 또한 입자 형성을 위한 반응이 각각의 미세 액적 내에서만 한정되어 진행되기 때 문에 핵생성 및 결정성장을 제어하기가 용이하므로 전구 체의 농도 설정이 상대적으로 자유롭다. 더 나아가 입자 형성을 위한 전구체의 분해 및 결정화 반응이 상대적으로 고온에서 진행되기 때문에, 추가적인 하소(calcination) 공 정이 필요하지 않아 입자의 성장 및 강한 응집을 억제할 수 있으며, 액적의 발생 및 공급, 이송 과정과 열처리를 연 속적으로 진행할 수 있어 배치형의 용액 기반 합성공정에 비해 대량생산에 유리하다는 장점을 가지고 있다. 하지만 초음파에 의해 생성된 액적의 크기가 수 백 나노미터에서 수 십 마이크로미터 수준이기 때문에, 열분해에 의해 생성 된 입자도 수십 나노미터 수준의 1차 입자가 강하게 응집 된 조대한 2차 입자의 형태를 갖게 되는 문제점이 있다.
- 본 연구에서는 기존 USP 공정에 질산나트륨(NaNO3)을 희생물질로 도입하는 염 보조 초음파 분무 열분해 공정 (Salt-Assisted Ultrasonic Spray Pyrolysis, SA-USP)을 통해 기존 USP 공정의 단점을 극복하고 미세한 TiO2 나노입자 를 합성하고자 하였다. 이와 같이 SA-USP로 제조된 분말 은 1차 입자 사이에 NaNO3가 존재하는 복합재료의 형태 이며, 세정 공정을 통해 NaNO3를 제거함으로써 미세한 1 차 입자를 얻을 수 있다. 또한 NaNO3는 고온의 결정화 과 정에서 발생할 수 있는 입자 성장을 최소화시키고 입자 간 응집을 억제하는 역할을 한다. 이러한 SA-USP 공정은 다양한 산화물 나노입자를 합성하기 위해 활용되어왔으나 [13-15], 아직까지 TiO2 나노입자에 대한 연구는 보고된 바가 없는 것으로 확인된다. 따라서 본 연구에서는 SAUSP 공정을 이용하여 TiO2 나노입자의 합성을 시도하고, 첨가된 NaNO3의 농도가 입자의 크기 및 형상에 대해 미 치는 영향을 고찰하고자 한다.
1. 서 론
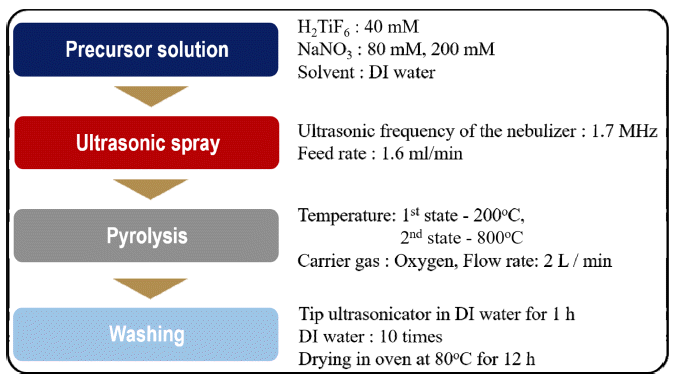
- TiO2 나노입자의 합성 공정은 전구체 용액 제조, 분무 및 열분해와 세척공정 순으로 구성되어 있으며, 공정 순서 를 Fig. 1에 정리하였다. 전구체 용액은 40 mM의 불화티 탄산 수용액(hexafluorotitanic acid solution, 60 wt% H2TiF6 in H2O, Sigma-Aldrich)과 희생물질인 질산나트륨(NaNO3, 99%, Sigma-Aldrich)을 각각 80 mM과 200 mM의 농도로 초 순수(distilled water)에 용해하여 제조하였다. 준비된 용 액은 미세 정량 펌프를 통해 1.6 ml/min의 유량으로 초음 파 분무 열분해 장비로 공급되었으며, 1.7 MHz로 설정된 초음파 진동자에 의해서 미세 액적의 형태로 관상로 내부 로 분무되었다. 미세액적은 고 순도 산소에 의해 관상로 내부로 이송되었고, 운반 가스의 농도는 2 lpm의 속도로 공급하였다. 관상로의 내부 온도는 두 단계로 나눠 설정하 였으며, 각각 200°C와 800°C로 설정하여 미세 액적내의 용매 증발 및 출발 물질의 열분해 그리고 결정화를 유도 하였다. 최종적으로 관상로의 상부에 필터페이퍼(filter pater)가 삽입된 유리 필터를 이용하여 합성된 분말을 취 득하였다. 합성된 분말로부터 NaNO3를 제거하기 위해, 초 음파 분산기(ultrasonicator, VC-505, Sonics & Materials, USA) 및 원심 분리기(centrifugal separator, 1236R, Labogene, Korea)를 이용해 초 순수로 5번 이상 세척을 실시하였다.
- 상기의 공정으로 합성된 분말의 형상과 직경은 전계 방 사형 주사 현미경(field emission-scanning electron microscopy, FE-SEM, JSM-6700F, JEOL, Japan)을 이용하여 관 찰하였고, X-선 회절분석기(X-ray diffractometer, XRD, X'Pert3 Powder, PANalytical, Netherlands)를 사용하여 분 말의 결정구조를 확인하였다. 또한 투과전자현미경 (transmission electron microscopy, TEM, JEM-2100F, JEOL) 을 이용하여 보다 상세하게 미세구조를 분석하였다. 분말 의 광학적 특성은 자외선/가시광선 분광광도계(UV-vis spectrophotometer, UV-2600, SHIMADZU, Japan)를 이용 해 흡광도를 측정해 확인하였다.
2. 실험 방법
Fig. 1
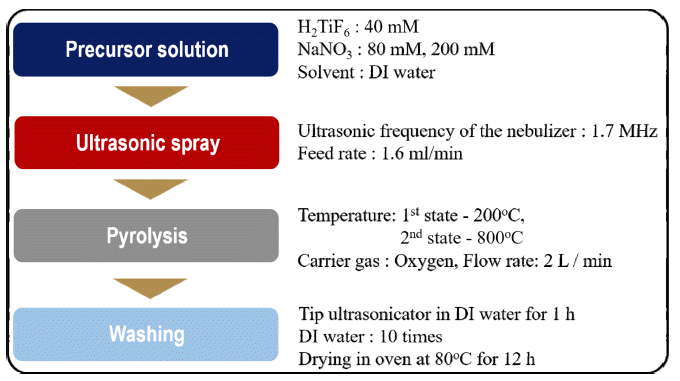
Experimental procedures to synthesize TiO2 nanoparticles using a salt-assisted ultrasonic spray pyrolysis.

- Fig. 2는 전구체와 NaNO3를 각각 1:2 와 1:5의 비율로 혼합하여 800°C에서 합성한 분말의 주사전자현미경 사진 이며, 수 백 나노미터에서 수 마이크로미터 수준의 넓은 입도 분포를 갖는 입자들을 관찰할 수 있다. 입자의 형상 은 구형에 가까웠으며, 입자 표면의 거칠기를 통해 미세한 1차 입자가 응집되어 조대한 2차 입자를 형성한 것을 알 수 있다. 전구체 용액에 첨가된 NaNO3의 농도에 따른 뚜 렷한 차이는 관찰되지 않았다. Fig. 3은 USP로 제조된 분 말에서 세척 공정을 통해 NaNO3를 제거하여 수득한 분말 의 주사전자현미경 사진이며, 세척 전과 비교하여 뚜렷한 형상의 변화가 관찰되었다. H2TiF6와 NaNO3의 몰 비를 1:2로 설정하여 제조된 분말은 구형의 형상을 유지하거나 껍질형태의 형상을 주로 나타내었고 일부는 미세한 입자 형태로 관찰되었다. 특히, 구형을 유지하는 입자는 내부가 비어있는 중공형 구조로 확인되었다. 전구체와 금속염의 몰 비가 1:5인 용액으로부터 제조된 분말은 세척 전과 같 은 구형의 형상은 관찰되지 않았으며, 입자의 크기가 현저 하게 작아진 것을 알 수 있다. 상대적으로 낮은 NaNO3 농 도에서 제조된 경우, 초기 제조된 분말 내에 NaNO3의 양 이 부족하여 개개의 1차 입자를 효과적으로 분리하지 못 하고, NaNO3가 제거된 영역이 비어 있는 중공형태 또는 껍질형태가 형성되는 것으로 설명할 수 있다. 반면에 보다 높은 농도의 NaNO3를 포함한 용액을 이용한 경우, NaNO3가 티타늄 전구체로부터 제조된 1차 입자 사이에 균질하게 분포하고, 이어진 세척공정을 통해 NaNO3를 제 거하여 1차 입자들이 효과적으로 분리될 수 있었기 때문 에 세척 전과 비교해서 현저하게 작은 크기의 분말이 형 성될 수 있었다고 사료된다.
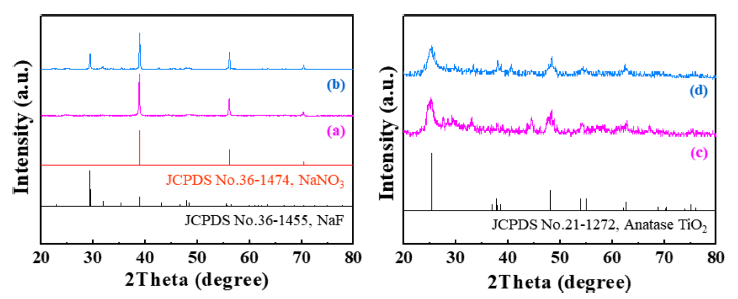
- 합성한 분말의 결정구조는 X-선 회절 분석을 통해 확인 하였으며, 그 결과를 Fig. 4에 나타내었다. Fig. 4(a)와 (c) 는 각각 H2TiF6와 NaNO3의 몰 비율이 1:2로 제조된 분말 의 세척 전과 세척 후의 X-선 회절 패턴이다. NaNO3를 제 거하기 전의 분말에서는 NaNO3의 회절패턴 만이 관찰되 지만, 세정이후에는 NaNO3의 회절패턴은 나타나지 않았 고, TiO2의 회절패턴만이 관찰되었다. Fig. 4(b)에서 보여 주듯이, H2TiF6와 NaNO3의 몰 비율이 1:5로 제조된 분말 은 세척 전에 NaNO3와 NaF가 동시에 관찰되었다. 이는 NaNO3의 낮은 비점(boiling point, 308°C)으로 인해, 공정 온도인 800°C에서 과량으로 첨가된 NaNO3의 일부가 기 화되는 과정에서 H2TiF6의 F와 반응하여 NaF를 형성한 것으로 사료된다. Fig. 4(d)는 세척 공정을 통해 얻은 분말 의 X-선 회절분석 결과이다. 세척 후에는 NaNO3와 NaF 의 회절패턴은 관찰되지 않았으며, 이는 NaF가 물에 대한 용해도를 갖는 화합물(40.4 g/L)이기 때문에 NaNO3를 세 척하는 과정에서 제거되었다고 판단된다. X-선 회절분석 에서 관찰된 회절패턴은 anatase TiO2(JCPDS#: 21-1272) 로 확인되었고, Fig. 4(d)에서 (101) 면과 (200) 면의 회절 패턴으로부터 얻은 반가폭과 Scherrer eq.을 이용하여 계 산한 결정 크기는 (101)면의 경우 약 9.2 nm, (200)면은 약 11.6 nm로 확인되었다.
- 합성한 입자의 직경과 미세구조를 보다 정확하게 관찰 하기 위해 투과전자현미경 분석을 실시하였다. Fig. 5는 H2TiF6와 NaNO3를 1:5의 비율로 제조한 용액을 초음파 분무 열분해 및 세척 공정을 거쳐 최종적으로 합성된 TiO2 나노 입자의 투과전자현미경 사진이다. 약 8 nm 크 기의 입자가 균일하게 합성되었음을 알 수 있다. 또한 관 찰된 격자줄무늬(lattice fringe)로부터 합성된 나노입자는 준수한 결정성을 가지고 있고, 각 입자 간의 계면 구조를 통해 개개의 입자는 원자 간 결합에 의한 화학적인 응집 이 아닌 물리적으로 약하게 응집되어 있음을 알 수 있다. Fig. 5(a) 내부에 Fig. 5(a)에 대한 selected area electron diffraction (SAED) 패턴을 나타내었으며, SAED 패턴 분 석을 통해 합성된 나노입자가 TiO2라는 것을 재차 확인할 수 있었다.
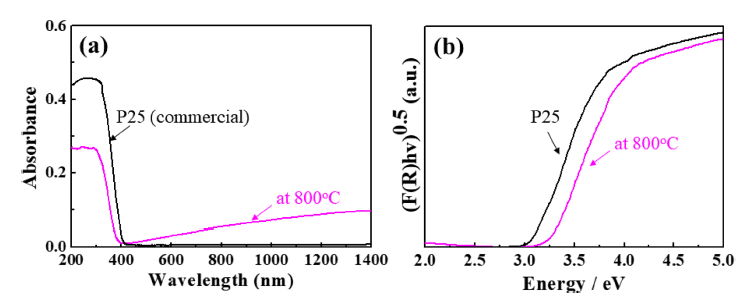
- Fig. 6는 H2TiF6와 NaNO3를 1:5의 비율로 제조한 용액 으로부터 합성된 TiO2 나노입자의 광학적 특성을 보여주 며, 자외선/가시광선 분광광도계를 이용하여 분석한 흡광 도 그래프와 분말의 흡광도와 확산 반사율(diffuse reflection) 을 Kubelka-Munk 식으로 변환한 그래프이다. 분말의 광학적 특성은 상용 TiO2 나노분말(P25, 대구텍)과 비교하 였다. 합성된 나노입자는 약 380 nm 영역에서 강한 흡수 를 나타내었고, 밴드갭 에너지는 약 3.25 eV로 확인되어 anantase 상 TiO2의 고유 물성과 유사하였다. 상용 TiO2 나 노입자(P25, 대구텍)와 비교하여 약간 큰 밴드갭 에너지를 나타내었고, P25의 경우, anatase 상(Eg = 3.2 eV)과 rutile 상(Eg = 3.0 eV)이 80:20의 분율로 혼합되어 있는 데 반해, 본 연구를 통해 합성된 TiO2 나노입자는 순수한 anatase 상을 가지고 있기 때문에 밴드갭 에너지의 차이가 발생된 것으로 판단된다.
3. 결과 및 고찰
Fig. 2

FE-SEM images of TiO2/NaNO3 composite powders synthesized the ultrasonic spray pyrolysis with the different molar ratios of TTIP and NaNO3: (a, b) 1:2 and (c,d) 1:5.

Fig. 3

FE-SEM images of the powders shown in Fig. 2 after washing treatment to remove the NaNO3: the molar ratios of TTIP and NaNO3 are (a, b) 1:2 and (c, d) 1:5.

Fig. 4
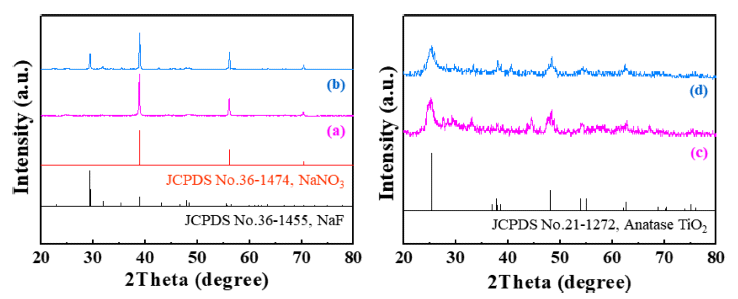
XRD patterns of the powder synthesized by a NaNO3-assisted ultrasonic spray pyrolysis process at 800°C (a, b) before and (c, d) after the washing treatment. The molar ratios of TTIP and NaNO3: (a, c) 1:2 and (b, d) 1:5.

Fig. 5

(a) TEM and (b) high-resolution TEM images of the TiO2 nanoparticles synthesized by the NaNO3-assisted ultrasonic spray pyrolysis process at 800°C and the washing treatment. The inset of (a) is SAED pattern according to the (a).

Fig. 6
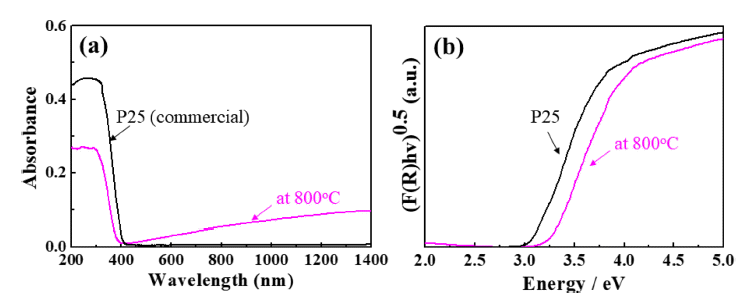
(a) UV-Vis diffuse absorption spectra and (b) the plots of the transformed Kubelka-Munk function versus the absorbed light energy of the synthesized TiO2 nanoparticles and a commercial TiO2 nanoparticles.

- 본 연구에서는 기존 USP 공정에 NaNO3을 희생물질로 도입하는 염 보조 초음파 분무 열분해 공정(Salt-Assisted Ultrasonic Spray Pyrolysis, SA-USP)을 통해 약 10 nm 수 준의 평균직경을 갖는 TiO2 나노입자를 합성하였다. 첨가 된 NaNO3 농도에 의한 영향을 고찰한 결과, H2TiF6와 NaNO3의 몰 비를 1:2로 설정하여 제조된 분말은 중공형 구조를 형성하거나, 껍질형태의 형상을 주로 나타내었고, H2TiF6와 NaNO3의 비율이 1:5 수준일 때, 약 10 nm의 평 균 직경을 갖는 아나타제 TiO2 나노입자를 얻을 수 있었 다. 열분해 과정에서 전구체 간의 반응을 통해 NaF2상이 일부 형성되었으나, NaNO3의 용해 과정에서 함께 제거된 것을 확인하였고, 제조된 나노입자는 순수한 아나타제 TiO2로 확인되었다. TEM 분석결과는 제조된 나노입자가 준수한 결정성을 갖는 것을 보여주었다. 합성된 TiO2 나노 입자의 밴드갭 에너지는 약 3.25 eV로 확인되었다. 이러한 분석 결과를 통해, 합성된 TiO2 나노입자는 TiO2의 다양한 적용분야에 적합한 수준의 성질을 갖는 것으로 판단된다.
4. 결 론
-
Acknowledgements
- 이 연구는 서울과학기술대학교 교내연구비의 지원으로 수행되었습니다.
감사의 글
- 1. X. Chen and S. S. Mao: Chem. Rev., 107 (2007) 2891. .ArticlePubMed
- 2. Y. Cai and Y. P. Feng: Prog. Surf. Sci., 91 (2016) 183. .Article
- 3. J.-S. Lee, Y.-I. Lee, H. Song, D.-H. Jang and Y.-H. Choa: Curr. Appl Phys., 11 (2011) S210. .Article
- 4. Y. Ma, X. Wang, Y. Jia, X. Chen, H. Han and C. Li: Chem. Rev., 114 (2014) 9987. .ArticlePubMed
- 5. M. Tahir and N. S. Amin: Appl. Catal. B, 162 (2015) 98. .Article
- 6. Y.-I. Lee, J.-S. Lee, E.-S. Park, D.-H. Jang, J.-E. Lee, K. Kim, N. V. Myung and Y.-H. Choa: J. Nanosci. Nanotechnol., 14 (2014) 8005. .Article
- 7. W. Li, F. Wang, S. Feng, J. Wang, Z. Sun, B. Li, Y. Li, J. Yang, A. A. Elzatahry, Y. Xia and D. Zhao: J. Am. Chem. Soc., 135 (2013) 18300. .ArticlePubMed
- 8. R. Thapa, S. Maiti, T. H. Rana, U. N. Maiti and K. K. Chattopadhyay: J. Mol. Catal. A: Chem., 363-364 (2012) 223. .Article
- 9. Q. Qu, H. Geng, R. Peng, Q. Cui, X. Gu, F. Li and M. Wang: Langmuir, 26 (2010) 9539. .ArticlePubMed
- 10. G. L. Messing, S.C. Zhang and G. V. Jayanthi: J. Am. Ceram. Soc., 76 (1993) 2707. .Article
- 11. J. H. Bang and K. S. Suslick: Adv. Mater., 22 (2010) 1039. .ArticlePubMed
- 12. Z. Cheng, P. Foroughi and A. Behrens: Ceram. Int., 43 (2017) 3431. .Article
- 13. G.-H. An, H.-J. Wang, B.-H. Kim, Y.-G. Jeong and Y.-H. Choa: Mater. Sci. Eng. A, 449-451 (2007) 821. .Article
- 14. Y.-M. Choi, Y.-I. Lee, S. Kim and Y.-H. Choa: J. Alloy Compd., 615 (2014) 496. .Article
- 15. Y. Hwangbo and Y.-I. Lee: J. Alloy Compd., 771 (2019) 821. .Article
Figure & Data
References
Citations
Citations to this article as recorded by 

- Effect of Pyrolysis temperature on TiO2 Nanoparticles Synthesized by a Salt-assisted Ultrasonic Spray Pyrolysis Process
Jae-Hyun Yoo, Myeong-Jun Ji, Woo-Young Park, Young-In Lee
Journal of Korean Powder Metallurgy Institute.2019; 26(3): 237. CrossRef
Synthesis and Optical Property of TiO2 Nanoparticles Using a Salt-assisted Ultrasonic Spray Pyrolysis Process
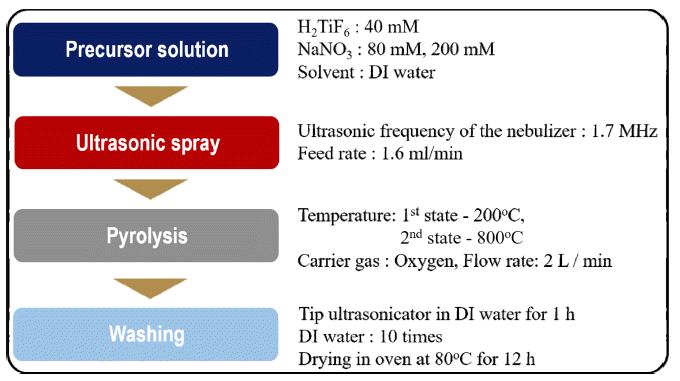


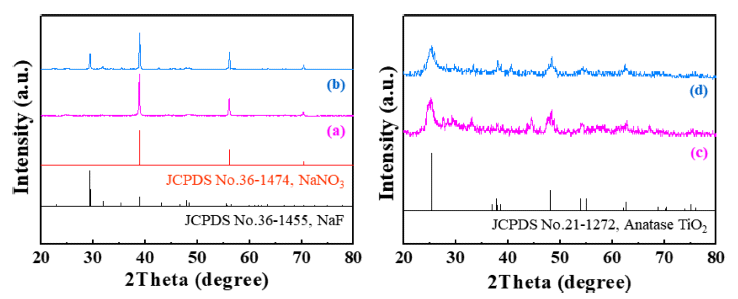

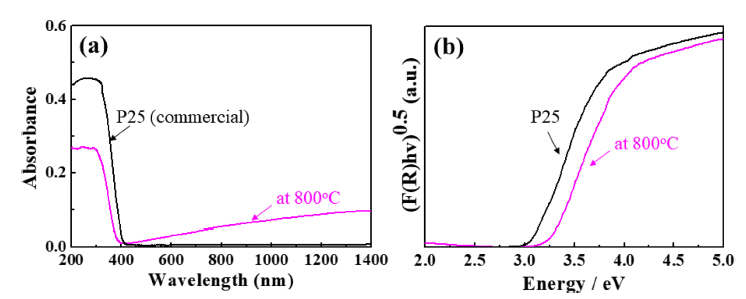
Fig. 1
Experimental procedures to synthesize TiO2 nanoparticles using a salt-assisted ultrasonic spray pyrolysis.
Fig. 2
FE-SEM images of TiO2/NaNO3 composite powders synthesized the ultrasonic spray pyrolysis with the different molar ratios of TTIP and NaNO3: (a, b) 1:2 and (c,d) 1:5.
Fig. 3
FE-SEM images of the powders shown in Fig. 2 after washing treatment to remove the NaNO3: the molar ratios of TTIP and NaNO3 are (a, b) 1:2 and (c, d) 1:5.
Fig. 4
XRD patterns of the powder synthesized by a NaNO3-assisted ultrasonic spray pyrolysis process at 800°C (a, b) before and (c, d) after the washing treatment. The molar ratios of TTIP and NaNO3: (a, c) 1:2 and (b, d) 1:5.
Fig. 5
(a) TEM and (b) high-resolution TEM images of the TiO2 nanoparticles synthesized by the NaNO3-assisted ultrasonic spray pyrolysis process at 800°C and the washing treatment. The inset of (a) is SAED pattern according to the (a).
Fig. 6
(a) UV-Vis diffuse absorption spectra and (b) the plots of the transformed Kubelka-Munk function versus the absorbed light energy of the synthesized TiO2 nanoparticles and a commercial TiO2 nanoparticles.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Synthesis and Optical Property of TiO2 Nanoparticles Using a Salt-assisted Ultrasonic Spray Pyrolysis Process
TOP
 KPMI
KPMI

 Cite this Article
Cite this Article