Articles
- Page Path
- HOME > J Powder Mater > Volume 31(4); 2024 > Article
-
Research Article
TiH2 분말의 볼 밀링과 탈수소화에 의한 Ti 나노분말 제조 및 미세조직 특성 - 김지영, 이의선, 최지원, 김영민, 오승탁*
- Preparation and Microstructural Characteristics of Ti Nanopowder by Ball Milling and Dehydrogenation of TiH2 Powder
- Ji Young Kim, Eui Seon Lee, Ji Won Choi, Youngmin Kim, Sung-Tag Oh*
-
Journal of Powder Materials 2024;31(4):324-328.
DOI: https://doi.org/10.4150/jpm.2024.00199
Published online: August 30, 2024
서울과학기술대학교 신소재공학과
Department of Materials Science and Engineering, Seoul National University of Science and Technology, Seoul 01811, Republic of Korea
- *Corresponding Author: Sung-Tag Oh, TEL: +82-2-970-6631, FAX: +82-2-973-6657, E-mail: stoh@seoultech.ac.kr
• Received: July 26, 2024 • Accepted: August 19, 2024
© The Korean Powder Metallurgy & Materials Institute
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 1,179 Views
- 17 Download
Abstract
- This study analyzed the influence of ball size and process control agents on the refinement and dehydrogenation behavior of TiH2 powder. Powders milled using ZrO2 balls with diameters of 0.1 mm, 0.3 mm, and 0.3+0.5+1 mm exhibited a bimodal particle size distribution, of which the first mode had the smallest size of 0.23 μm for the 0.3 mm balls. Using ethanol and/or stearic acid as process control agents was effective in particle refinement. Thermogravimetric analysis showed that dehydrogenation of the milled powder started at a relatively low temperature compared to the raw powder, which is interpreted to have resulted from a decrease in particle size and an increase in defects. The dehydrogenation kinetics of the TiH2 powder were evaluated by the magnitude of peak shift with heating rates using thermogravimetric analysis. The activation energy of the dehydrogenation reaction, calculated from the slope of the Kissinger plot, was measured to be 228.6 kJ/mol for the raw powder and 194.5 kJ/mol for the milled powder. TEM analysis revealed that both the milled and dehydrogenated powders showed an angular shape with a size of about 200 nm.
- 상대적으로 낮은 밀도, 높은 비강도 및 우수한 내식성을 가지는 티타늄(Ti)은 항공우주, 국방, 의료 등 여러 분야에서 광범위하게 활용되고 있으나 고온 반응성 및 난가공성 등의 문제가 있어 용해 및 주조 등 일반적인 가공공정으로는 부품제조에 한계가 있다[1-3]. 따라서 최종 형상에 가까운 부품 제조가 가능한 분말야금 공정이 적용되고 있으며, 특히 치밀체 제조를 위해 우수한 소결성을 나타내는 나노크기 Ti 분말의 사용이 요구되고 있다[4]. 나노크기 분말은 주로 기계적 또는 화학적 방법을 이용하여 합성하고 있으며 이중에서 고에너지 볼 밀링은 변형과 파괴의 반복과정으로 Ti 원료분말을 미세화할 수 있다는 점에서 많은 관심의 대상이 되고 있다. 그러나 이러한 제조방법은 밀링 중에 불순물 혼입, 응집체 형성 및 장시간이 요구되는 단점이 있다[5].
- 따라서 최근에는 Ti 분말대신 상대적으로 높은 취성을 가지는 TiH2를 원료분말로 사용하여 밀링시간을 최소화하고, 계속해서 고온에서 탈수소화하여(dehydrogenation) Ti의 산화가 억제된 고순도 미세분말로 제조하는 연구가 제시되고 있다[6]. 그러나 이러한 방법을 적용하기 위해서는 볼 밀링 단계에서 회전속도 및 볼 크기 등 공정변수와 함께 탈수소화 거동에 대한 정량적인 이해가 요구된다. 본 저자들은 선행연구를 통해, 3 mm와 5 mm 크기의 볼을 조합하여 유성형 볼 밀링할 경우가 TiH2 분말의 미세화에 최적조건임을 보고한 바 있으나[7], 밀링 중 입자의 파괴가 주로 볼의 접촉 지점에서 발생하는 것을 고려할 때 볼의 크기가 작을수록 접촉점이 증가하여 분쇄효율이 향상될 것으로 예상됨으로 이에 대한 추가적인 연구가 필요하다[8]. 또한, 밀링한 분말을 Ti와 H2로 분해하는 열처리 조건은 합성된 Ti 분말의 상 및 입자크기 등 미세조직 특성에 직접적으로 영향을 미치기 때문에 탈수소화 거동에 대한 정량적인 해석이 요구된다.
- 본 연구에서는 TiH2 분말의 볼 밀링과 탈수소화 공정을 조합하여 나노크기의 Ti 분말을 제조하고자 하였다. 볼 밀링 공정의 최적화를 위해 원료분말의 미세화에 미치는 볼 크기 및 공정제어제(process control agents)의 영향을 분석하였다. 또한 승온속도에 따른 원료분말과 밀링한 분말의 상 및 무게변화를 분석하여 분해반응 온도와 활성화 에너지 등 TiH2의 탈수소화 거동을 해석하였다. 최종적으로 입자크기 및 미세조직 등 분말특성을 분석하여 Ti 나노분말 제조를 위한 볼 밀링과 탈수소화 공정의 최적조건을 제시하고자 하였다.
1. Introduction
- 나노크기의 Ti 분말 제조를 위한 원료로는 TiH2 분말(99%, -325 mesh, Alfa Aesar, USA)을 사용하였다. 볼 밀링은 ZrO2 용기와 볼을 사용하여 유성형 볼 밀 장비에서 진행하였으며 분말형상 및 상세한 밀링 공정은 기존논문에서 보고한 바 있다[7]. 밀링공정에서 볼 크기가 분말 미세화 미치는 영향을 해석하기 위해 각각 직경 0.1 mm, 0.3 mm 및 1 mm의 볼을 사용하였으며 볼과 분말의 무게 비는 25:1로 하였다. 유성형 볼 밀의 회전속도는 500 rpm으로 하였고, 밀링과정 중 과도한 압접을 방지하기 위해 공정제어제로 에탄올(ethyl alcohol) 및 스테아르산(stearic acid)을 첨가하여 밀링효과를 분석하였다.
- TiH2 분말의 탈수소화 거동은 열중량분석기(TGA, DTG-60H, Shimadzu)를 이용하여 아르곤 분위기에서 5-40°C/min의 승온속도로 800°C까지 가열하며 무게변화를 측정하여 해석하였다. 분말의 크기는 동적광산란(DLS, nanoSAQLA, Otsuka) 입도분석기를 이용하여 측정하였다. 탈수소화 온도에 따른 분말의 상변화는 X-선 회절분석기(XRD, Miniflex 300, Rigaku Denki Co.)를 이용하여 분석하였고, 미세조직 특성은 주사전자현미경(SEM, JSM-6700F, JEOL)과 투과전자현미경(Cs-STEM, NEO ARM/JEOL, JEOL)을 이용하여 해석하였다.
2. Experimental Procedure
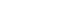
- 볼 크기가 원료분말의 미세화에 미치는 영향을 분석하기 위해 다양한 직경을 가지는 볼을 사용하여 500 rpm의 회전속도로 5시간 동안 밀링하였다. 그림 1은 원료분말과 밀링한 분말의 입도분포를 나타낸 것으로 작은 크기의 분말과 조대한 응집체가 같이 존재하는 전형적인 이중 입도분포곡선을 나타낸다. 원료분말의 경우 약 0.5 μm와 19 μm 크기에서 최빈값(mode)의 피크가 존재하나, 0.1 mm의 볼을 사용하여 밀링한 경우는 약 1 μm와 120 μm의 크기에서 피크가 위치하여 증가된 값을 보여준다. 상대적으로 작은 크기의 0.1 mm 볼을 사용할 경우는 볼의 충돌에 의해 발생되는 기계적 에너지가 작아 파단효과가 없으며 오히려 분말 간의 압접 등이 일어나 입자크기가 증가된 것으로 해석된다[8, 9].
- 한편, 그림 1의 결과와 같이 0.1 mm 보다 큰 크기의 볼을 사용하여 밀링할 경우에는 원료분말과 비교하여 최빈값 피크가 작은 크기 쪽으로 이동하여 원료분말의 미세화에 효과적임을 알 수 있다. 0.3 mm의 볼과 0.3+0.5+1 mm 크기의 볼 조합을 비교하면, 0.3 mm 볼을 사용할 경우는 이중 입도분포곡선에서 첫번째 최빈값이 0.23 μm에 위치하여 다양한 크기의 볼 조합을 사용할 경우인 0.4 μm보다 작은 값을 나타낸다. 그러나 응집체 크기인 두번째 피크는 0.3 mm의 경우 8 μm이고 0.3+0.5+1 mm 볼 크기 조합에서는 3.3 μm로 더 큰 값을 보여주며, 이는 밀링한 분말을 SEM으로 관찰한 그림 2의 사진으로도 확인할 수 있다. 이러한 입도분포의 차이는 우선적으로 볼 크기 증가에 따른 분쇄효율의 향상에 기인한 것으로 설명할 수 있으며, 다양한 볼 크기 조합을 사용하여 밀링한 분말에서 첫번째 최빈값이 상대적으로 큰 입자크기를 갖는 이유는 첨가한 전체 볼의 무게가 일정한 조건에서 작은 크기 볼의 개수가 상대적으로 감소되어 미세분말의 분쇄효율이 낮아졌기 때문으로 해석된다[10, 11]. 따라서 원료분말의 미세화를 목적으로 한 본 연구에서는 상대적으로 미세한 입자크기를 나타내었던 0.3 mm 볼을 사용하여 밀링하는 경우를 최적조건으로 판단하였다.
- 그림 3은 분말 미세화에 미치는 공정제어제의 영향을 분석하기 위해 각각 에탄올 또는 에탄올에 스테아르산을 혼합하여 밀링한 분말의 크기변화를 나타낸 결과이다. 입도분포곡선은 동적광산란 방법으로 측정한 크기를 개수분포(number distribution)로 도시한 것이며[12], 에탄올에 스테아르산을 혼합한 공정제어제를 사용한 경우가 더 작은 입자크기를 보여주었다. 일반적으로 고에너지 밀링과정에서 공정제어제는 원료분말의 과도한 압접을 방지하여 분말의 파쇄 효율을 향상시키는 것을 고려할 때[9], 본 실험조건에서는 에탄올과 스테아르산의 혼합이 입자 미세화에 더 효과적임을 알 수 있다.
- TiH2 분말의 탈수소화 반응에 미치는 밀링효과를 분석하기 위해 TGA를 이용하여 아르곤 가스분위기에서 승온속도에 따른 무게변화를 측정하였다. 그림 4(a)와 (b)는 각각 원료분말과 밀링한 분말의 온도에 따른 상대무게 값을 온도에 대해 1차 미분한 후 무게변화율(dW/dT)로 나타낸 것으로 각 피크는 상대무게의 변화 속도가 최대가 되는 온도(Tm), 즉 반응이 최대로 일어나는 온도이다. 원료분말의 경우 약 485°C 및 630°C 영역에서 피크가 관찰되며, 밀링한 분말은 상대적으로 더 낮은 온도인 약 285°C, 380°C 및 515°C 영역에서 피크가 관찰된다. 이러한 피크온도의 감소는 볼 밀링에 의해 입자크기가 감소하고 결함농도가 증가하여 분해반응이 활성화되었기 때문으로 해석된다[7].
- 그림 5는 온도에 따른 무게변화율을 나타낸 그림 4(b)에서 각각의 피크 시작온도까지 밀링한 분말을 가열한 후에 분석한 XRD 결과이다. 350°C까지 가열한 경우는 TiH2 상으로만 존재하여 탈수소화 반응이 일어나지 않았음을 알 수 있으며, 400°C에서는 TiH1.5 및 TiH0.71 상이 형성되고 최종적으로 450°C에서는 Ti상으로 존재하여 탈수소화 반응이 진행되었음을 나타낸다. 이러한 결과는 TiH2의 탈수소화 반응이 TiHx의 중간상을 거쳐 Ti 상으로 형성된다는 기존의 보고와 일치한다[13, 14]. 따라서 그림 4의 원료분말에서 관찰되는 두개의 피크와 밀링한 분말에서 관찰되는 약 380°C 및 515°C 영역에서 피크는 TiHx 및 Ti의 형성과 관련된 것이며, 약 285°C 이하에서의 피크는 탈수소화 반응과 무관한 공정제어제 등의 제거와 관련된 것으로 해석된다.
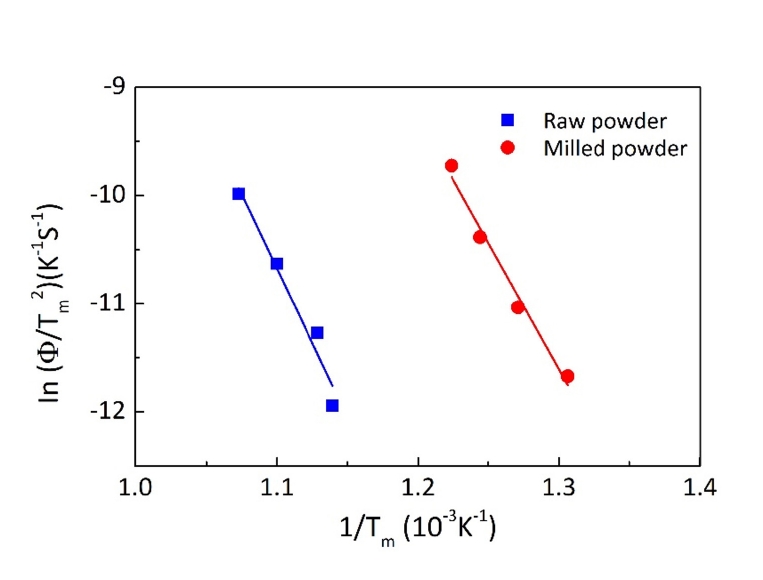
- 탈수소화 반응에서 온도에 따른 무게변화율을 나타낸 그림 4와 같이, 승온속도가 증가함에 따라 피크온도의 위치가 고온부위로 이동함을 알 수 있으며, 이는 TiH2의 분해가 열적 활성화 과정임을 의미한다. 따라서 승온속도에 따른 피크온도의 변화는 탈수소화 반응에 대한 활성화 에너지와 관련됨으로 Kissinger 식을 이용하여 그 값을 계산할 수 있다[15]. 그림 6은 각각 원료분말과 밀링 한 분말에서 TiHx가 Ti로 변환되는 최대 반응온도(Tm)를 그림 4에서 구한 후, 승온속도(Φ)를 ln(Φ/Tm)에 대입하여 y축으로 하고 x축은 1/Tm로 하여 나타낸 결과이다. 각 직선의 기울기로부터 활성화 에너지를 계산하면 원료분말은 228.6 kJ/mol, 밀링한 분말은 194.5 kJ/mol의 값을 얻을 수 있다. 측정한 값은 겉보기 활성화 에너지로 분말의 크기 및 밀링 정도, 측정 시 가스분위기의 종류와 분석장비 등에 의존하기 때문에 기존에 보고된 값과의 직접적인 비교가 어려우나, 기존 논문에서 제시된 131.9-268 kJ/mol의 범위에 포함되는 값이다[6, 14, 16]. 따라서 본 연구에서 계산한 활성화 에너지 값은 TiH2의 탈수소화 반응거동을 해석할 수 있는 중요한 기초자료를 제공한다는 점에서 의미 있는 결과로 판단한다.
- 그림 7은 밀링한 분말 및 탈수소화한 분말을 TEM 및 selected area electron diffraction (SAED)로 분석한 결과이다. 그림 7(a)는 직경 0.3 mm 볼과 공정제어제로 에탄올과 스테아르산을 첨가하여 밀링한 분말의 미세조직 사진으로 약 200 nm 크기를 갖는 각형입자의 형상을 나타낸다. 그림 7(b) 및 (c)와 같이 탈수소화 처리한 분말도 유사한 크기를 나타내며 SAED 분석결과 Ti 및 TiO2 상이 존재함을 알 수 있다. 이는 기존의 논문에서 보고된 바와 같이[17, 18], Ti이 합성된 후 산소와의 높은 반응성으로 분말표면에 TiO2 피막이 형성되었기 때문으로 설명된다.
3. Results and Discussion
- 본 연구에서는 TiH2 분말의 미세화에 미치는 볼 크기 및 공정제어제의 영향을 분석하고 탈수소화 거동을 해석하였다. 직경 0.1 mm, 0.3 mm 및 0.3+0.5+1 mm 크기의 ZrO2 볼을 사용하여 밀링한 분말은 이중 입도분포를 나타내었으며, 0.3 mm 볼의 경우 첫번째 최빈값이 0.23 μm로 가장 작은 크기를 보여주었다. 공정제어제로는 에탄올과 스테아르산을 사용할 경우가 입자 미세화에 최적임을 확인하였다. TiH2 분말의 탈수소화 거동은 TGA를 이용하여 분석하였으며, 원료분말과 비교하여 밀링한 분말에서 탈수소화가 상대적으로 낮은 온도에서 시작되었고 이는 입자크기 감소와 결함농도 증가에 의한 분해반응의 활성화로 해석하였다. XRD 분석결과 TiH2의 분해반응은 TiHx의 중간상 형성을 거쳐 최종적으로 Ti로 변환됨을 확인하였다. 승온속도에 따른 무게변화로부터 Kissinger 식으로 계산한 탈수소화 반응의 활성화 에너지는 원료분말의 경우 228.6 kJ/mol, 밀링한 분말은 194.5 kJ/mol의 값을 나타내었다. TEM 분석결과 밀링한 분말 및 탈수소화한 분말은 약 200 nm 크기를 갖는 각형입자의 형상을 나타내었으며, 탈수소화한 분말에서는 합성된 Ti의 높은 산소와의 반응성으로 일부 산화물 상이 관찰되었다.
4. Conclusion
-
Conflict of Interest
저자들은 이해상충관련 해당사항 없음을 선언합니다.
-
Author Information and Contribution
김지영, 이의선, 최지원, 김영민 : 학생, 오승탁 : 교수
Article information
-
Acknowledgements
- 이 논문은 한국연구재단의 PM 연구실 회복 지원을 받아 수행된 연구입니다(PM2023ST0011).
Fig. 1.Particle size distribution of raw and ball-milled powders prepared for 5 h with different ball size combinations.
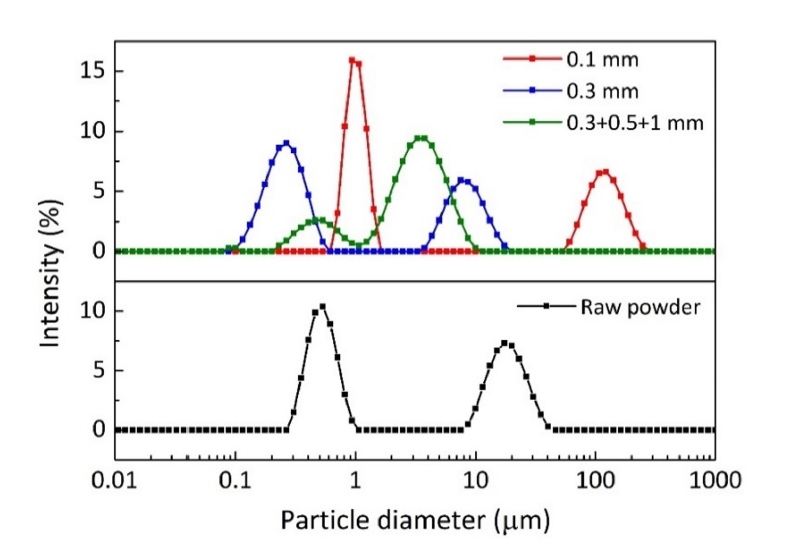

Fig. 2.SEM images of TiH2 powder prepared by milling for 5 h at 500 rpm using (a) 0.3 mm and (b) 0.3+0.5+1 mm diameter balls.


Fig. 3.Effect of process control agents on the particle diameter of ball-milled powders processed for 5 h.
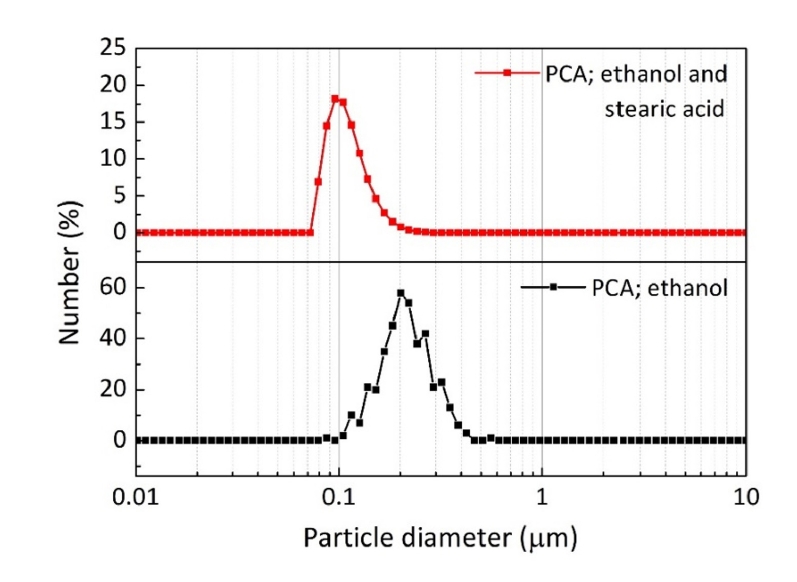

Fig. 4.Differential TGAcurves at different heating rates for (a) raw and (b) ball-milled TiH2 powders in an Ar atmosphere.

Fig. 5.XRD profiles of the ball-milled powders, heat-treated at different temperatures in an Ar atmosphere.
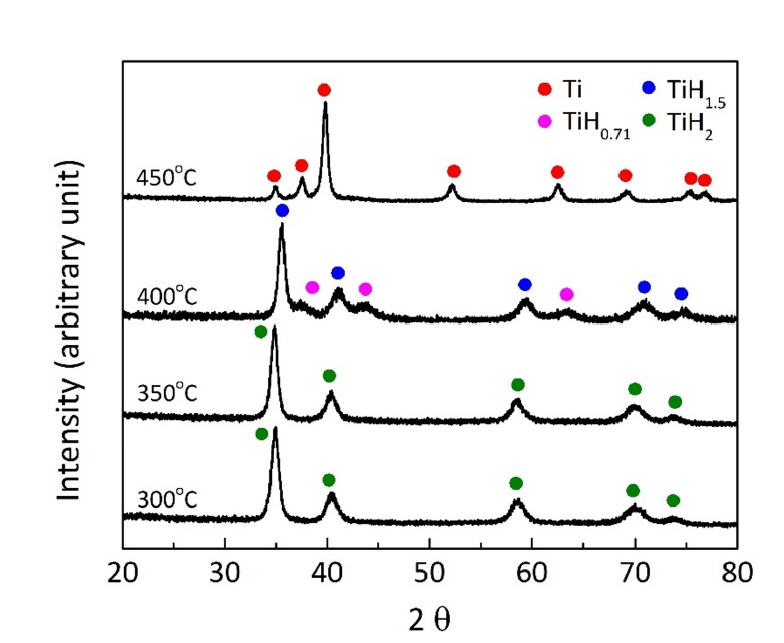

Fig. 7.TEM image of (a) ball-milled and (b) dehydrogenated powder, and (c) SAED pattern of the dehydrogenated powder.


- 1. M. J. Donachie, Titanium: A Technical Guide, 2nd EditionASM international, Ohio (2000).
- 2. L. Kang and C. Yang: Adv. Eng. Mater., 21 (2019) 1801359.
- 3. Z. Z. Fang, J. D. Paramore, P. Sun, K. S. R. Chandran, Y. Zhang, Y. Xia, F. Cao, M. Koopman and M. Free: Int. Mater. Rev., 63 (2018) 407.ArticlePDF
- 4. B. B. Panigrahi, M. M. Godkhindi, K. Das, P. G. Mukunda, V. V. Dabhade and P. Ramakrishnan: J. Mater. Res., 20 (2005) 827.Article
- 5. V. V. Dabhade, T. R. Rama Mohan and P. Ramakrishnan: Powder Technol., 171 (2007) 177.Article
- 6. V. Bhosle, E. G. Baburaj, M. Miranova and K. Salama: Mater. Eng. A., 356 (2003) 1.
- 7. J. Y. Kim, E. S. Lee, J. W. Choi, Y. Kim and S.-T. Oh: J. Powder Mater., 31 (2024) 132.ArticlePDF
- 8. H. Shin, S. Lee, H. S. Jung and J.-B. Kim: Ceram. Int., 39 (2013) 8963.Article
- 9. C. Suryanarayana: Prog. Mater. Sci., 46 (2001) 1.Article
- 10. L. G. Austin, K. Shoji and P. T. Luckie: Powder Technol., 14 (1976) 71.Article
- 11. S.-M. Hong, J.-J. Park, E.-K. Park, K.-Y. Kim, J.-G. Lee, M.-K. Lee, C.-K. Rhee and J. K. Lee: Powder Technol., 274 (2015) 393.Article
- 12. J. Wachlmayr, C. Hannesschlaeger, A. Speletz, T. Barta, A. Eckerstorfer, C. Siligan and A. Horner: Nanoscale Adv., 4 (2022) 58.Article
- 13. Y. Zhang, C. Wang, X. Guo and Y. Chen: Mater. Manuf. Process., 34 (2019) 921.Article
- 14. A. Rasooli, M. A. Boutorabi, M. Divandari and A. Azarniya: Bull. Mater. Sci., 36 (2013) 301.ArticlePDF
- 15. H. E. Kissinger: Anal. Chem., 29 (1957) 1702.Article
- 16. K. G. Prashanth: Mater. Manuf. Process., 25 (2010) 974.Article
- 17. C. Wang, L. Pan, Y. Zhang, S. Xiao and Y. Chen: Int. J. Hydrog. Energy., 41 (2016) 14836.Article
- 18. Y. Zhang, Z. Z. Fang, L. Xu, P. Sun, B. V. Devener, S. Zheng, Y. Xia, P. Li and Y. Zhan: J. Phys. Chem. C., 122 (2018) 20691.Article
References
Figure & Data
References
Citations
Citations to this article as recorded by 

Preparation and Microstructural Characteristics of Ti Nanopowder by Ball Milling and Dehydrogenation of TiH2 Powder
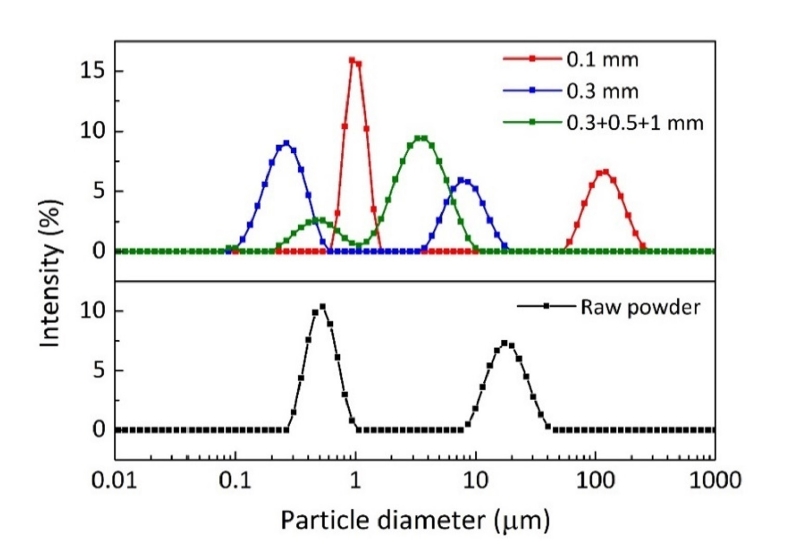

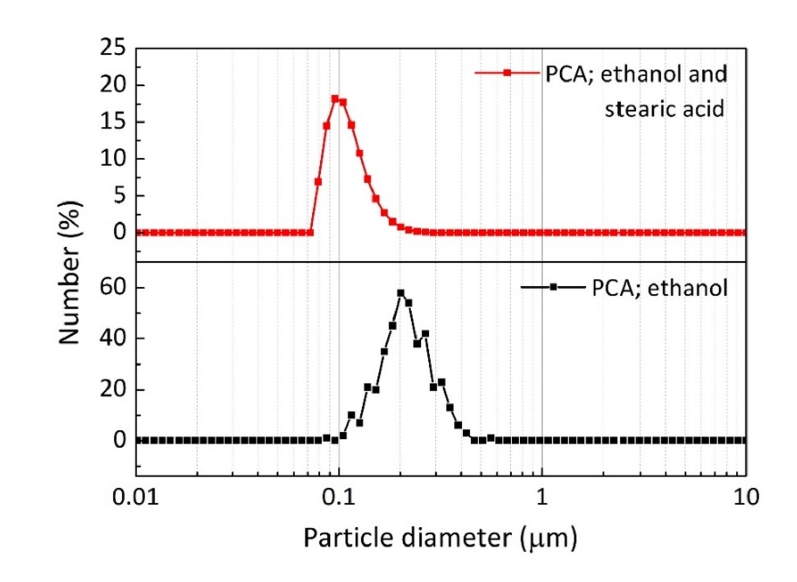
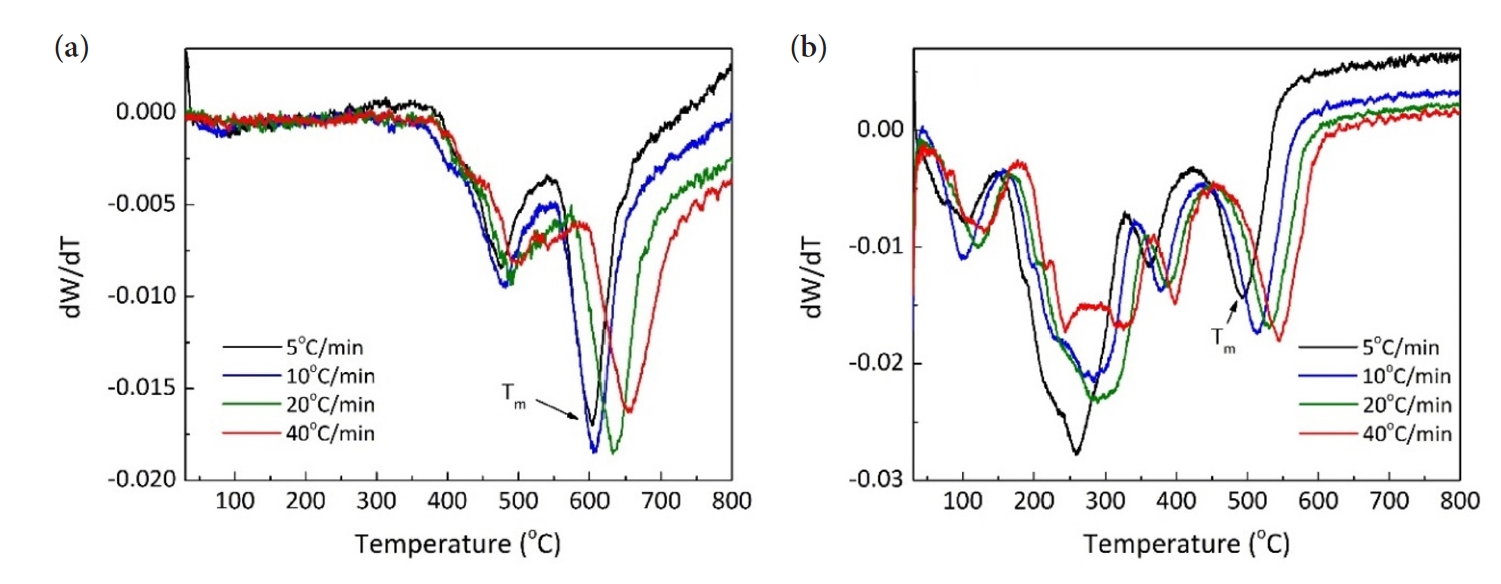
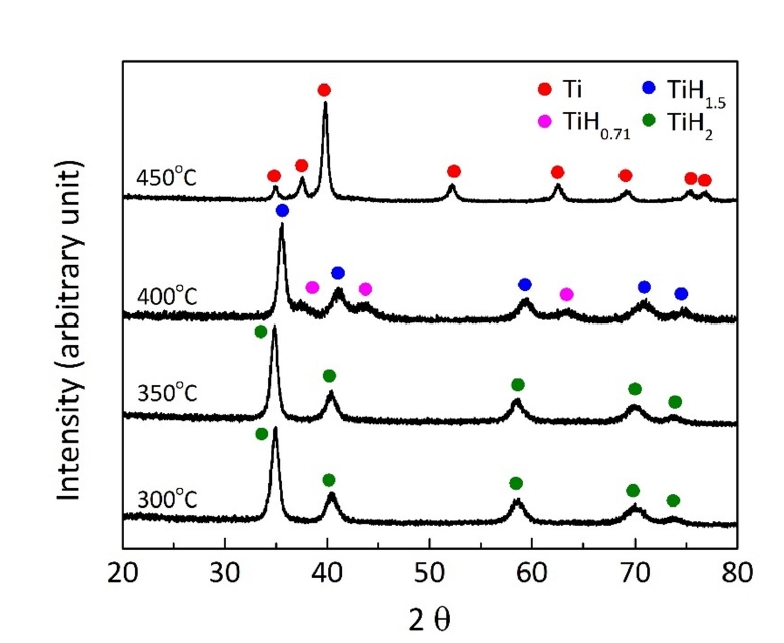
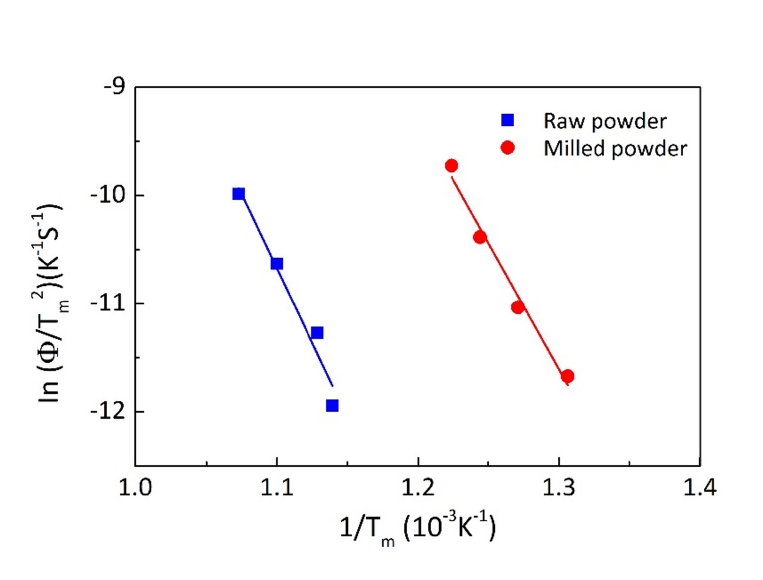

Fig. 1. Particle size distribution of raw and ball-milled powders prepared for 5 h with different ball size combinations.
Fig. 2. SEM images of TiH2 powder prepared by milling for 5 h at 500 rpm using (a) 0.3 mm and (b) 0.3+0.5+1 mm diameter balls.
Fig. 3. Effect of process control agents on the particle diameter of ball-milled powders processed for 5 h.
Fig. 4. Differential TGAcurves at different heating rates for (a) raw and (b) ball-milled TiH2 powders in an Ar atmosphere.
Fig. 5. XRD profiles of the ball-milled powders, heat-treated at different temperatures in an Ar atmosphere.
Fig. 6. Kissinger plots for the dehydrogenation of TiH2 powders.
Fig. 7. TEM image of (a) ball-milled and (b) dehydrogenated powder, and (c) SAED pattern of the dehydrogenated powder.
Fig. 1.
Fig. 2.
Fig. 3.
Fig. 4.
Fig. 5.
Fig. 6.
Fig. 7.
Preparation and Microstructural Characteristics of Ti Nanopowder by Ball Milling and Dehydrogenation of TiH2 Powder
TOP
 KPMI
KPMI

 ePub Link
ePub Link Cite this Article
Cite this Article