Articles
- Page Path
- HOME > J Powder Mater > Volume 30(4); 2023 > Article
-
Article
반응 인자 제어에 의한 산화철(Fe3O4) 나노클러스터의 크기와 자기 특성 조절 - 이상훈†, 변아림†, 최진실*
- Size Control of Iron Oxide (Fe3O4) Nanoclusters according to Reaction Factors and Consequent Change in Their Magnetic Attraction
- Sanghoon Lee†, Arim Byun†, Jin-sil Choi*
-
Journal of Korean Powder Metallurgy Institute 2023;30(4):297-304.
DOI: https://doi.org/10.4150/KPMI.2023.30.4.297
Published online: July 31, 2023
한밭대학교 화학생명공학과
Department of Chemical and Biological Engineering, Hanbat National University, Daejeon 34158, Republic of Korea
- * Corresponding Author: Jin-sil Choi, TEL: +82-42-821-1692, FAX: +82-42-821-1549, E-mail: jinsil.choi@hanbat.ac.kr
-
- 이상훈·변아림: 학생, 최진실: 교수
†These authors contribute this work equally.
• Received: July 15, 2023 • Revised: August 11, 2023 • Accepted: August 12, 2023
© The Korean Powder Metallurgy Institute. All rights reserved.
- 1,074 Views
- 13 Download
- 1 Crossref
Figure & Data
References
Citations
Citations to this article as recorded by 

- Enzymatic properties of iron oxide nanoclusters and their application as a colorimetric glucose detection probe
Dahyun Bae, Minhee Kim, Jin-sil Choi
RSC Advances.2025; 15(6): 4573. CrossRef
Size Control of Iron Oxide (Fe3O4) Nanoclusters according to Reaction Factors and Consequent Change in Their Magnetic Attraction
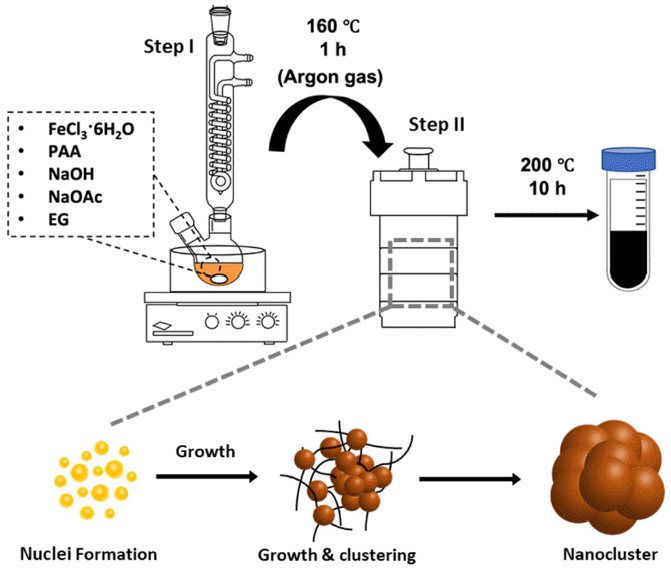

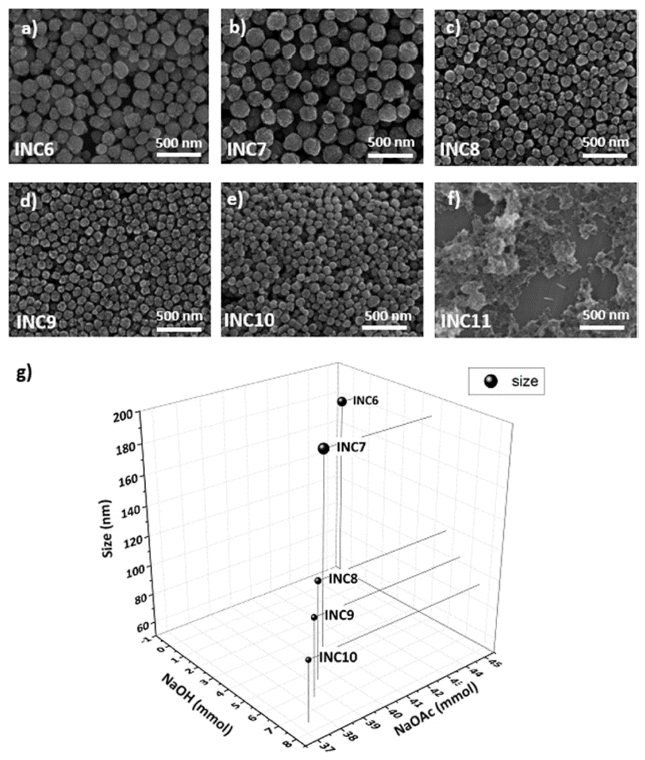
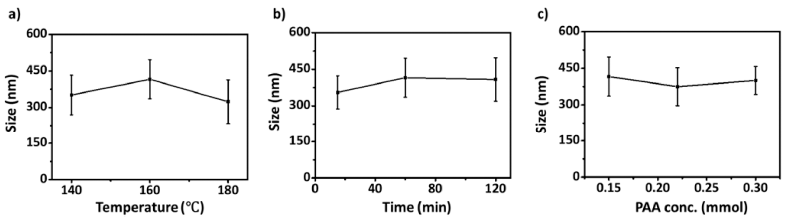
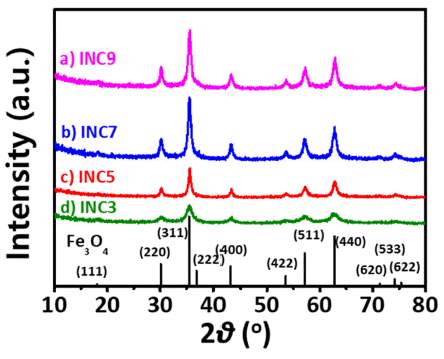
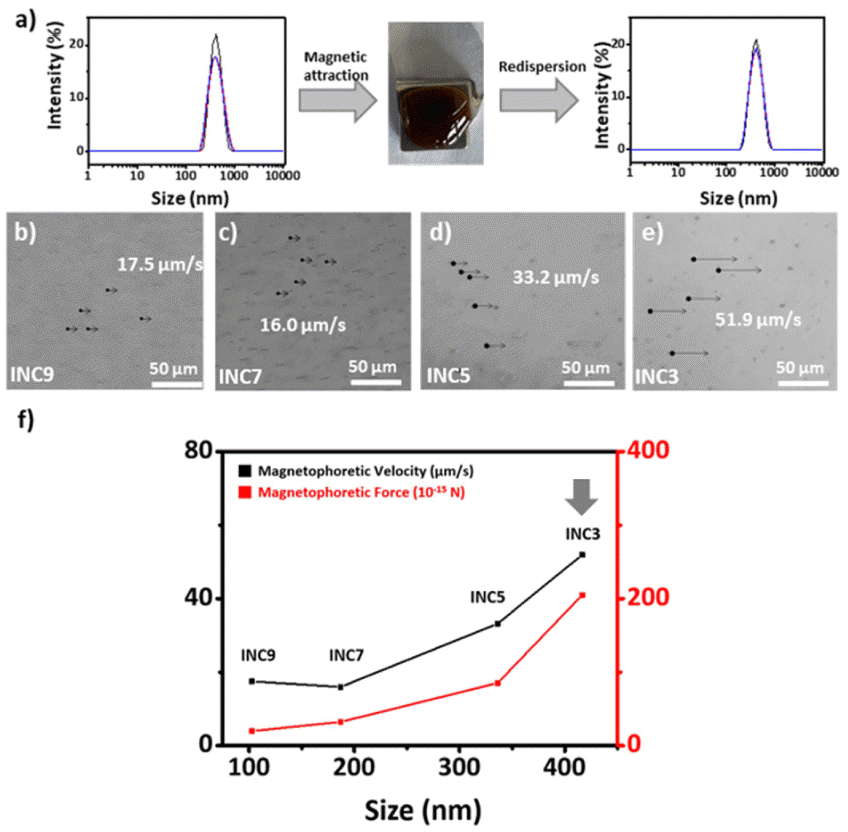
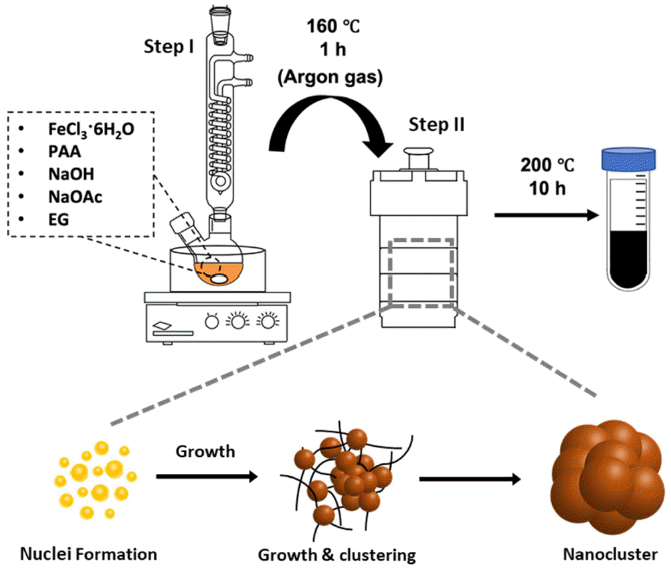
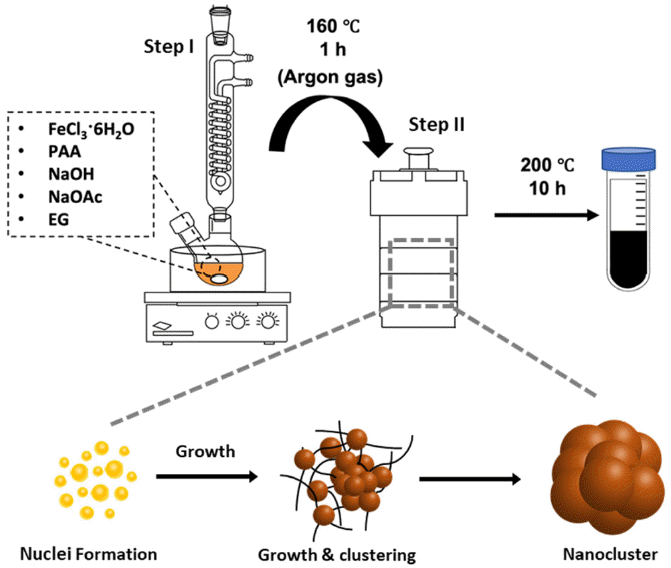
Fig. 1
Solvothermal synthesis of nanoclusters.
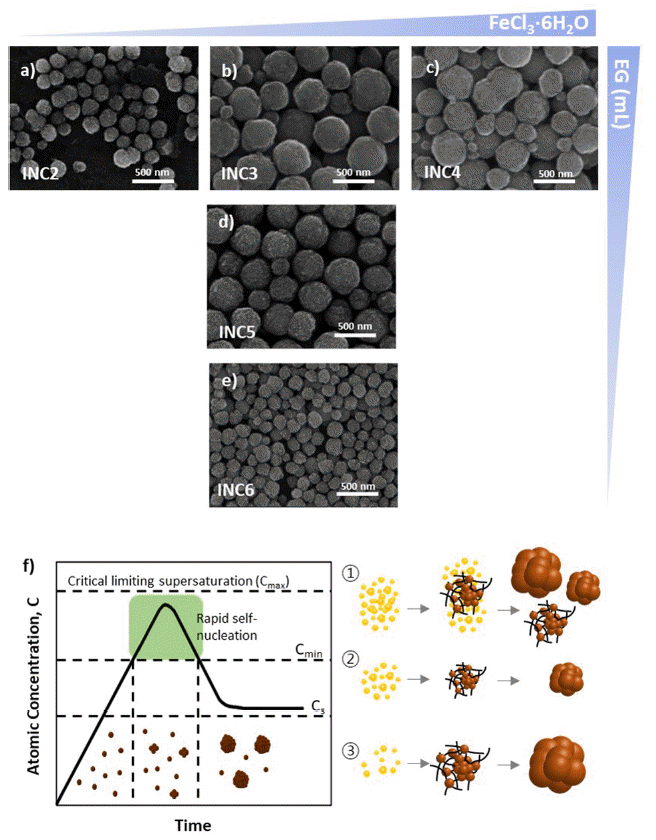
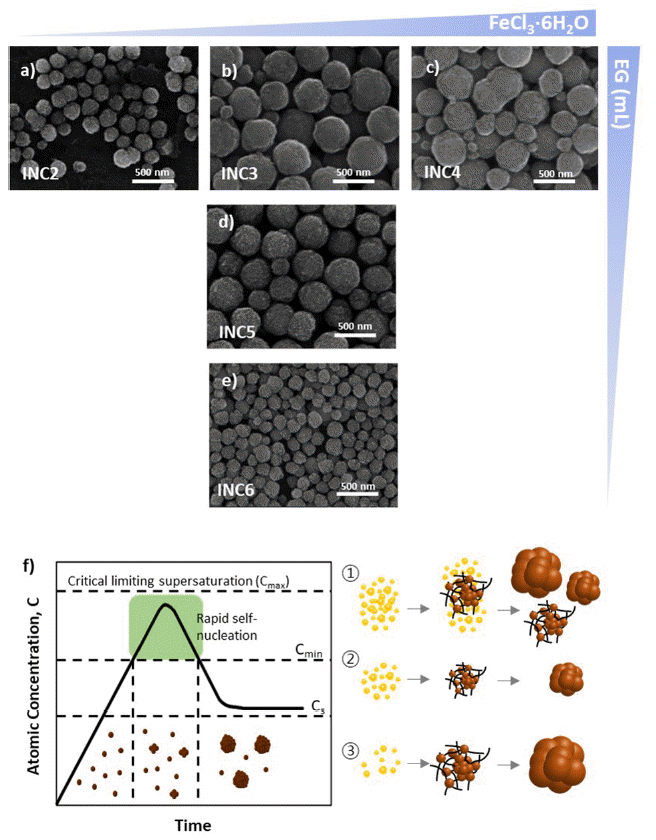
Fig. 2
SEM images of nanoclusters under the variation of (a-c) FeCl3·6H2O concentration and (b, d, e) solvent amount in reaction solution. (f) Schematics of LaMer model and various scenario of seed formation and growth of nanoclusters.
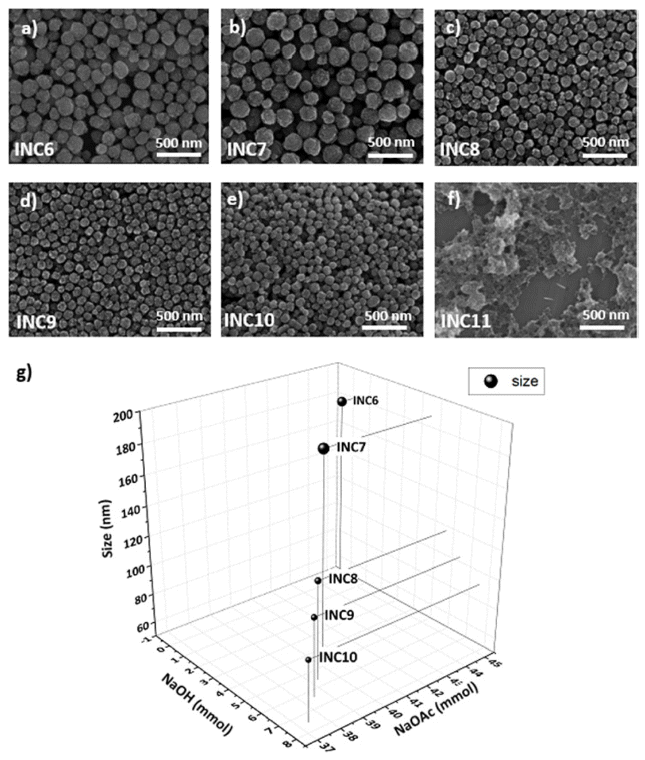
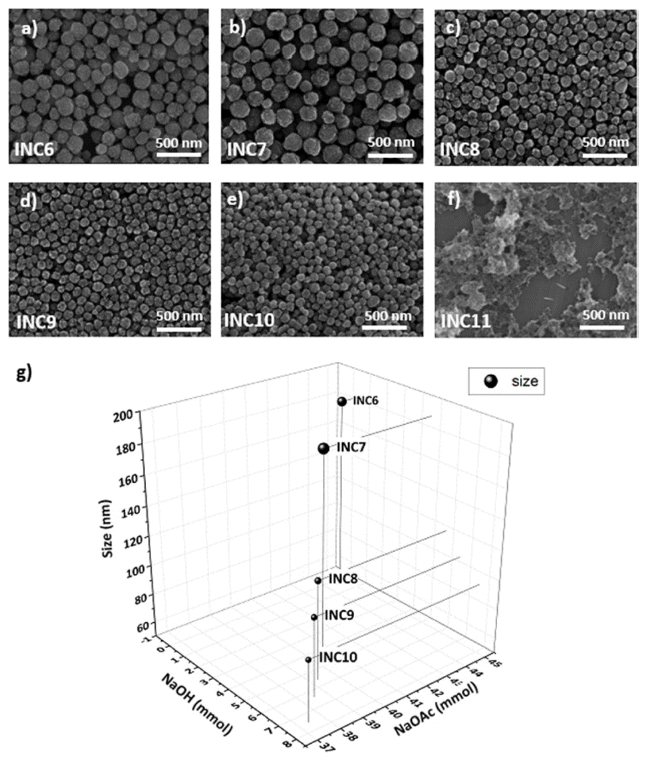
Fig. 3
SEM images of nanoclusters under the NaOH:NaOAc ratio; (a) INC6(0:1), (b) INC7(1:9), (c) INC8(1:7), (d) INC9(1:6), (e) INC10(1:5), (f) INC11(1:0). (g) The size variation graph of nanoclusters according to the base ratio and concentration.
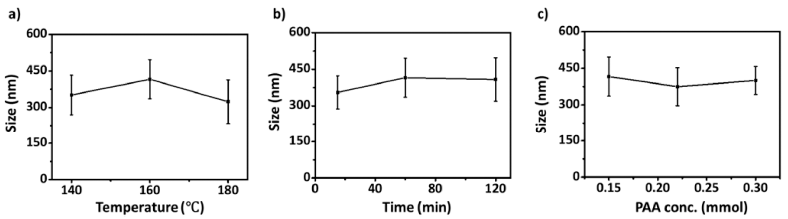
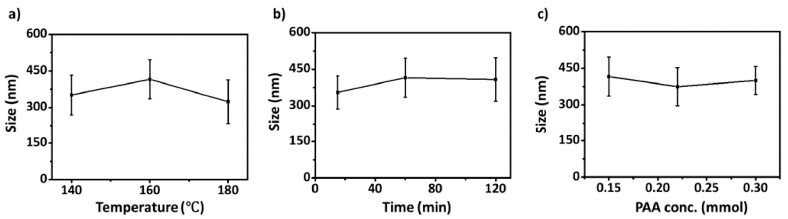
Fig. 4
Nanocluster size according to (a) temperature and (b) heating time of step I, and (c) PAA concentration.
Fig. 5
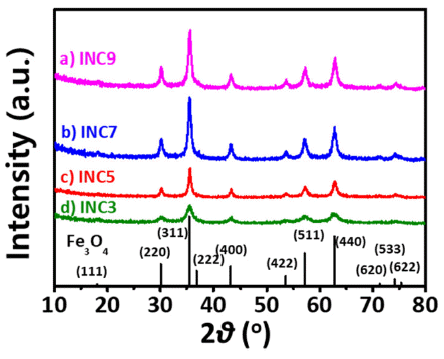
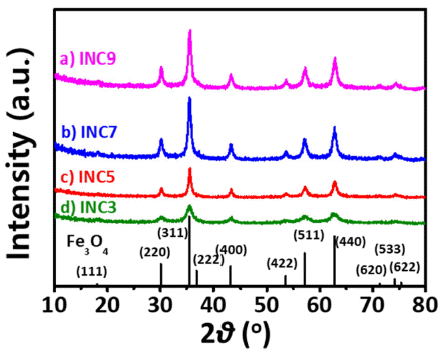
XRD patterns of various INCs; (a) INC9, (b) INC7, (c) INC5, and (d) INC3 (ref. JCPDS card #: 9002318).
Fig. 6
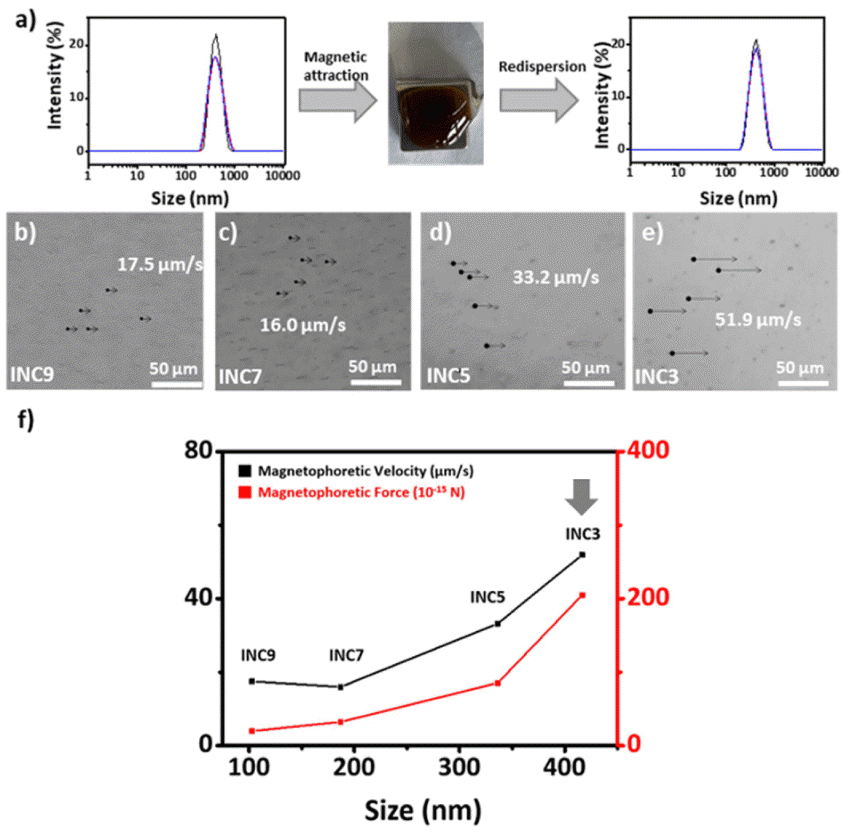
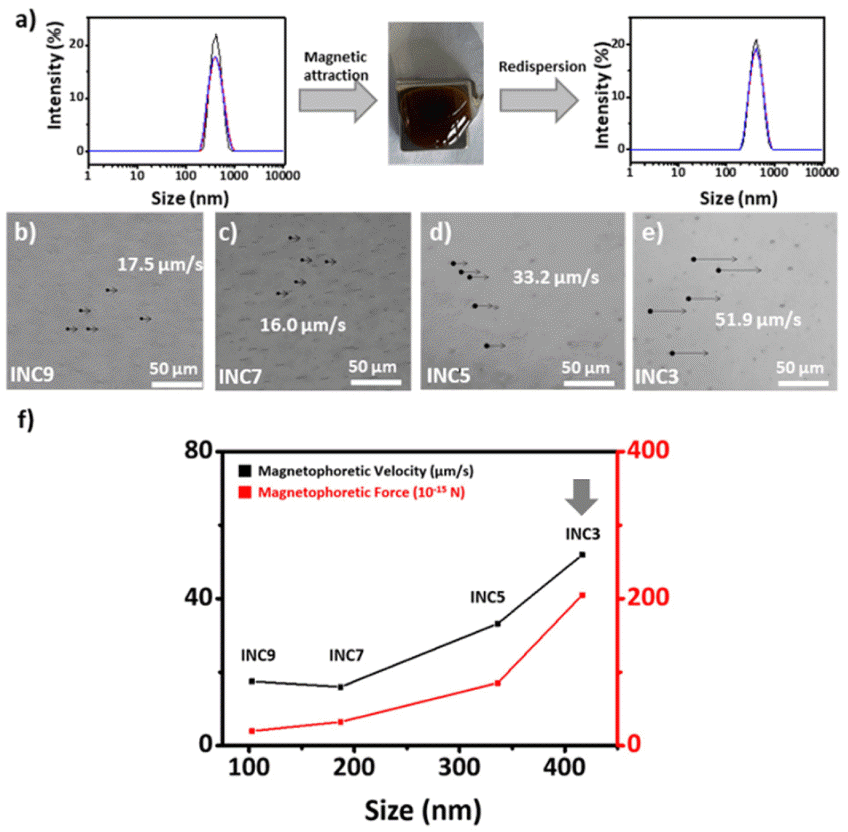
(a) Hydrodynamic size of nanoclusters before and after the magnetic attraction. Optical microscopy image of (b–e) nanoclusters according to size attracted by the NdFeB magnet. (f) Magnetophoretic velocity and force according to nanocluster size.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Size Control of Iron Oxide (Fe3O4) Nanoclusters according to Reaction Factors and Consequent Change in Their Magnetic Attraction
| Group | Control factor | Sample | FeCl3·6H2O (mmol) | PAA (mmol) | NaOAc (mmol) | NaOH (mmol) | EG (mL) |
|---|---|---|---|---|---|---|---|
|
|
|||||||
| I | Precursor concentration | INC1 | 1.3 | 0.15 | 44.9 | - | 30 |
| INC2 | 1.9 | ||||||
| INC3 | 2.5 | ||||||
| INC4 | 5.0 | ||||||
| II | Amount of solvent | INC5 | 2.5 | 0.15 | 44.9 | - | 20 |
| INC6 | 10 | ||||||
| III | Basicity | INC7 | 2.5 | 0.15 | 40.4 | 4.5 | 10 |
| INC8 | 39.3 | 5.6 | |||||
| INC9 | 38.5 | 6.4 | |||||
| INC10 | 37.4 | 7.5 | |||||
| INC11 | - | 44.9 | |||||
| Group | Control factor | Sample | Size (nm) |
|---|---|---|---|
|
|
|||
| I | Precursor concentration | INC1 | W: 799.2 ± 395.7 |
| L: 2809.8 ± 1033.5 | |||
| Hexagonal rod (ferrihydrite) | |||
| INC2 | 185.9 ± 29.0 | ||
| INC3 | 416.1 ± 80.6 | ||
| INC4 | 312.2 ± 94.0 | ||
| II | Amount of solvent | INC5 | 335.9 ± 71.3 |
| INC6 | 173.5 ± 20.8 | ||
| III | Basicity | INC7 | 187.0 ± 35.3 |
| INC8 | 116.6 ± 17.1 | ||
| INC9 | 103.1 ± 18.3 | ||
| INC10 | 91.2 ± 15.2 | ||
| INC11 | No cluster was formed | ||
Table 1
Iron oxide nanocluster synthesized from various compositions
Table 2
Summary of INCs’ size depending on the reaction condition
Table 1
Table 2
TOP
 KPMI
KPMI

 Cite this Article
Cite this Article