Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 24(3); 2016 > Article
-
ARTICLE
니켈 나노입자가 흡착된 에너제틱용 고반응성 알루미늄 분말 합성 - 김동원, 권구현, 김경태*
- Synthesis of Nickel Nanoparticle-adsorbed Aluminum Powders for Energetic Applications
- Dong Won Kim, Gu Hyun Kwon, Kyung Tae Kim*
-
Journal of Korean Powder Metallurgy Institute 2016;24(3):242-247.
DOI: https://doi.org/10.4150/KPMI.2017.24.3.242
Published online: May 31, 2016
한국기계연구원 부설 재료연구소 분말기술연구실
Powder Technology Department, Korea Institute of Materials Science, Changwon 51508, Republic of Korea
- *Corresponding Author: Kyung Tae Kim, +82-55-280-3506, +82-55-280-3289, ktkim@kims.re.kr
• Received: April 26, 2017 • Revised: May 19, 2017 • Accepted: May 22, 2017
© The Korean Powder Metallurgy Institute. All rights reserved.
- 1,248 Views
- 8 Download
- 8 Crossref
Abstract
- In this study, the electroless nickel plating method has been investigated for the coating of Ni nanoparticles onto fine Al powder as promising energetic materials. The adsorption of nickel nanoparticles onto the surface of Al powders has been studied by varying various process parameters, namely, the amounts of reducing agent, complexing agent, and pH-controller. The size of nickel nanoparticles synthesized in the process has been optimized to approximately 200 nm and they have been adsorbed on the Al powder. TGA results clearly show that the temperature at which oxidation of Al mainly occurs is lowered as the amount of Ni nanoparticles on the Al surface increases. Furthermore, the Ni-plated Al powders prepared for all conditions show improved exothermic reaction due to the selfpropagating high-temperature synthesis (SHS) between Ni and Al. Therefore, Al powders fully coated by Ni nanoparticles show the highest exothermic reactivity: this demonstrates the efficiency of Ni coating in improving the energetic properties of Al powders.
- 순수한 알루미늄(Aluminum, Al)은 산화반응 시 다른 금 속소재들에 비하여 우수한 에너지 방출 특성을 나타낸다. 특히, 알루미늄 분말의 경우 비표면적이 극대화됨에 따라 고반응성 재료(energetic material)로서 고체연료 및 추진제, 접합소재와 같은 민수와 국방 등 다양한 분야에서 활용 가치가 매우 높다고 할 수 있다[1, 2]. 하지만 알루미늄 분 말은 자연상태에서 자발적인 부동태화에 의한 수 나노미터 두께의 산화막이 표면에 치밀하게 형성되어 있어 상온, 상 압의 분위기에서 우수한 반응성을 확인하기 어려운 문제가 있다. 즉, 약 2300K의 높은 융점을 가지는 표면 산화막은 외부 산소와 내부 활성 알루미늄과의 직접적인 접촉을 방 지하므로 연소효율을 감소시키는 역할을 하는 것으로 알 려져 있다[3, 4]. 이와 같은 문제를 해결하기 위해 국내 및 해외에서의 선행 연구에서는 알루미늄 입자 표면에 불소 계 고분자[1, 5-7], 철[8], 팔라듐[9], 니켈[9, 10]등 유·무기 소재를 코팅함으로써 점화성과 연소효율을 일부 향상시키 기도 하였다.
- 이들 소재 중 니켈은 알루미늄 분말의 코팅이나 복합필 름의 형태로 최근까지 가장 많이 보고되고 있다[2, 9, 10]. 알루미늄-니켈 시스템에서의 가장 큰 장점은 두 금속 사 이에 자전연소합성(Self Propagating High Temperature Synthesis, SHS)이 가능하다는 것이다. 연소합성은 다른 반응 조건에서 얻어지지 않는 구조를 가진 열역학적으로 안정한 물질의 형성을 유도하는 강한 발열 화학반응으로, Ni-Al의 금속 간 화합물 형성 시 발생하는 발열에너지로 인해 알루미늄 분말의 점화가 촉진될 수 있다[11]. 또한, 니켈은 알루미늄 산화막(Al2O3)과 달리 열 전도성이 우수 하여 초소형 열 에너지원이나 접합응용분야에서도 활발한 응용이 진행되고 있어, 알루미늄 분말과 접목할 경우 다양 한 응용분야 개척이 가능하다.
- 보고된 대부분의 니켈 코팅 된 알루미늄 분말은 균일한 니켈 코팅이 이뤄지지 않아 국부적으로 니켈입자가 흡착되 어 있으며 니켈 함량도 5-10 wt% 이하이다[8, 12]. 최근 25 um급 알루미늄 입자에 무전해 니켈 도금을 이용해 코어 /쉘 타입의 연속적 니켈 코팅층을 가지는 합성분말의 특성 이 보고된 바 있다[13]. 그러나, 알루미늄 분말의 크기가 감 소될수록 우수한 에너제틱 물성을 나타냄에도 불구하고, 극 미세 분말의 제조 어려움과 표면처리의 어려움으로 인하여 1~10 um 범위의 극미세 알루미늄 분말 표면에 니켈 소재를 균일하게 코팅한 연구결과가 현재까지 보고된 바가 없다.
- 따라서, 본 연구에서는 평균 입도가 5 um인 미세 알루 미늄 분말 표면에 무전해 니켈 도금 공정을 이용하여 나 노입자를 부착시키는 연구를 수행하였다. 나노입자를 합 성하고 이를 표면에 도금하는 공정에서 니켈 무전해 도금 액 내의 환원제(reductant), 착화제(complexing agent), 안 정제(stabilizer)의 조성 및 pH 값의 변화를 통한 공정변수 제어 연구를 수행하여 니켈입자의 생성 경향과 흡착특성 을 조사하였다. 그리고, 합성된 니켈 나노입자가 코팅된 양에 따라 알루미늄 분말의 열적 산화거동을 비교·분석하 여 에너제틱 분말에 니켈 나노입자가 미치는 영향을 확인 하였다.
서 론
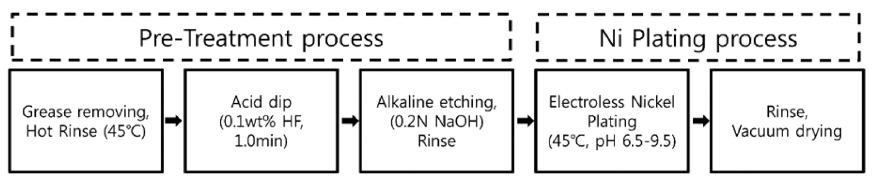
- 본 연구에 사용된 알루미늄 분말은 가스아토마이저(gas atomizer system)를 이용하여 제조된 평균입도 5 um 크기 의 구형 분말을 사용하였다. 무전해 니켈 도금액 제조에 사 용된 시약은 모두 Sigma-Aldrich사의 제품으로, 니켈 전구체 로서 황산니켈염(nickel sulfate hexahydrate, NiSO4·6H2O, 99%)과 환원제로 치아인산나트륨(sodium hypophosphite monohydrate, NaH2PO2·H2O > 99%), 착화제와 안정제로 구연산나트륨 (sodium citrate tribasic dehydrate, >99%), 말레산(maleic acid, >99%)을 사용하였다. 그림 1은 알루 미늄 분말의 전처리 공정과 무전해 니켈 도금 공정 과정 을 순차적으로 나타낸 모식도이다. 먼저, 알루미늄 분말의 탈지 및 산세처리를 통해 세척을 하고 알칼리 에칭 (etching)을 통해 산화막이 제거되도록 하였다. 에칭은 약 1.0 g의 알루미늄 분말을 0.2 N 수산화나트륨(NaOH) 용액 에 1분 동안 침지시키는 방법으로 이뤄졌으며, 산화막이 제거된 알루미늄은 미리 준비된 니켈 도금액에 즉시 분산 시켜 도금처리 하였다.
- 초기 도금 수용액은 2차 증류수에 0.02몰 황산니켈, 0.03 몰의 환원제와 착화제를 혼합후 교반하여 제조하였다. 표 1에 실험을 위해 제조된 니켈 도금액의 조성과 pH 값, 반 응온도, 반응시간을 나타내었다. 초기 도금액(Np-A)을 기 준으로 하여 환원제, 착화제, 안정제의 농도 및 pH 값의 변화에 따라 Np-B, Np-C, Np-D, Np-E 그리고 Np-F로 구 분하여 각 독립변수가 알루미늄 분말의 도금공정에 미치 는 영향을 살펴보고자 하였다.
- 니켈 나노입자가 흡착된 알루미늄 분말은 각 조건에 따 른 입자형상과 코팅 정도를 주사전자현미경(SEM, Hitachi SU-6600)을 이용하여 정성적으로 확인하였고, X선 회절분 석(XRD, Rigaku D/Max-2500)을 통해 검증하였다. 또한, 열중량분석(TGA, TA instruments, SDT-Q600)을 수행하여 순수 알루미늄 분말과 도금 분말의 산화거동을 확인하였 으며, 시차주사열량분석(DSC)을 통해 각 분말의 온도 구 간에 따른 열적거동을 비교·분석하였다. 열 분석은 각 시 편당 약 10 mg의 분말을 사용하였고, 분석 온도 범위는 298-1473K로 승온속도는 10K/min으로 수행하였다.
실험 방법
Table 1
Composition of the electroless nickel plating solution used in the experiment.
- 그림 2는 본 연구에서 사용된 알루미늄 분말의 SEM 이 미지와 분말 입자의 단면을 TEM으로 관찰한 이미지이다. 그림에서 확인되는 바와 같이 알루미늄 분말의 평균입도는 대부분 4-6 um 크기의 고른 분포를 보이고 있으며, 약 5.6 nm 두께의 표면 산화막이 형성되어 있음을 확인할 수 있다. 본 연구에서는 알루미늄 분말 표면에 산화막을 제거 하는 공정을 수행하지만, 공정 중에 표면 재산화가 쉽게 발생하는 경향이 있다. 그럼에도 불구하고, 알루미늄 분말 표면에서 산화막이 존재하는 상태에서도 Ni-O-Al 결합으 로 Ni입자는 용이하게 부착될 수 있는 것으로 알려져 있 다[12]. 이 점에 착안하여 본 연구에서는 Ni 나노입자를 다양한 형태로 Al분말에 부착시킬 수 있다.
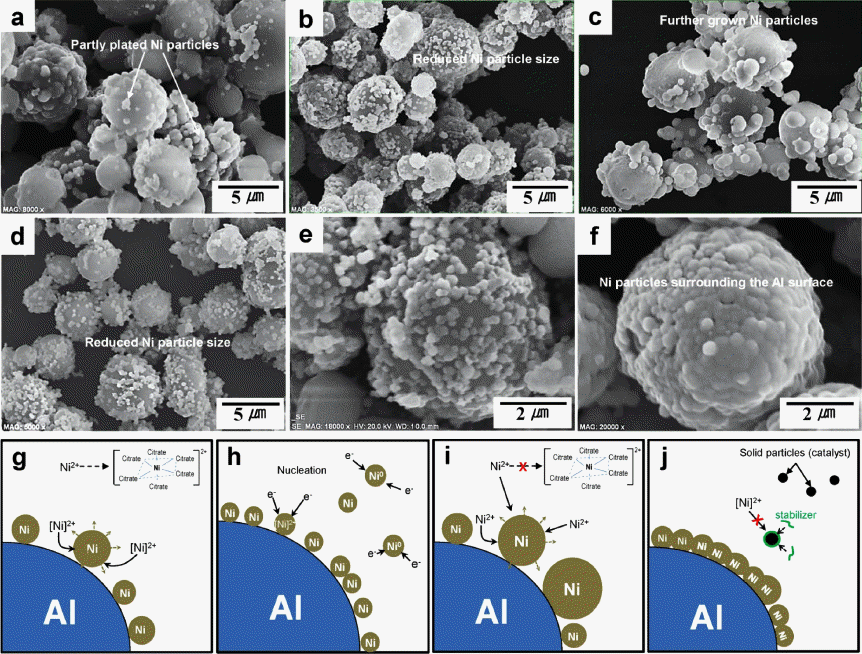
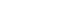
- 표 1에서 보는 바와 같이 Ni 나노입자 형성과 표면 부착 정도를 확인하기 위하여 도금액의 공정변수에 따른 샘플을 합성하였다. 도금액 변수는 초기조건인 Np-A를 기준으로 하여 환원제의 양, 착화제의 양 및 pH를 변화시켰다. 이를 각각 Np-B, Np-C, Np-D, Np-E 그리고 Np-F로 표현하였 다. 그림 3(a)~(f)는 초기 조건의 니켈 도금액인 Np-A를 바탕으로 환원제(Np-B)와 착화제(Np-C), pH 값(Np-D)을 단일변수로 변화시켰을 경우와 두 가지 이상의 조성(Np- E와 Np-F)을 제어했을 시 결과를 SEM 사진으로 나타내 었다. 그림 3(a)의 Np-A는 생성된 니켈입자의 크기가 균 일하지 않고 입자 간 응집이 발생하였음을 알 수 있으며, 알루미늄 표면에 부분적으로만 니켈입자가 흡착되어 있다. Np-A의 니켈입자 생성 메커니즘을 그림 3(g)와 같이 나타 내었다. 환원제의 농도를 4배가량 증가시킨 Np-B는 약 200 nm 크기의 비교적 균일한 입도를 가지는 니켈이 생성 되었고 알루미늄 분말의 표면적의 약 60%이상 흡착되었 다. 이는 그림 3(h)와 같이 도금 수용액 내 환원제가 증가 함에 따라 니켈 이온은 쉽게 전자를 받아 환원될 수 있으 므로, 분산된 알루미늄 입자들 표면에서 동시다발적으로 니켈 입자가 생성되어 흡착된 결과라 생각할 수 있다. Np- C는 착화제 농도를 감소시킴에 따라 니켈 입자가 불균일 성장했음을 보여준다. 일반적으로 니켈이온은 리간드 (ligand)와 배위결합하여 착화합물로서 용액 내 존재하고 주변 반응에 참여하게 되나, 그림 3(i)에 보여지듯 리간드 의 수가 부족해짐에 따라 자유 니켈이온이 상대적으로 증 가하게 되어 니켈입자의 무분별한 핵성장이 이뤄졌을 것 이라 판단된다. 그리고 Np-D의 경우, pH 조절제로 암모니 아수(NH4OH)를 이용하여 pH=8.9의 염기성 분위기에서 도금 된 결과이다. 도금액의 pH가 증가하면 다음의 반응 식 (1)에서와 같이 환원제의 산화반응이 더욱 잘 일어나게 된다[14].
- 즉, 환원제에 의한 니켈입자의 동시다발적 생성으로 인 하여 Np-B의 결과와 유사함을 보여준다. 그리고 알루미늄 입자는 표면에 수산화 이온 흡착으로 인한 정전기적 반발 력으로 분산안정성이 향상될 것이라 예상되고, 이로 인해 니켈입자의 흡착이 더욱 용이해 졌을 것이라 사료된다. 앞 서 니켈 입자의 생성 및 흡착에 효과를 나타낸 환원제의 농도와 pH 값을 동시에 적용시켜 합성 된 알루미늄 분말 (Np-E)은 그림 3(e)의 SEM 사진에서 보는 바와 같이 매우 균일한 크기의 니켈입자가 형성되어 흡착되어 있음을 확 인하였으나 알루미늄 표면이 완전히 코팅되지 않았음을 보여준다. 다음 그림 3(f)의 Np-F 분말은 Np-E의 합성 조 건에 0.1 mg의 안정제가 소량 첨가된 경우로, 니켈입자 크 기가 커진 반면 알루미늄 입자를 거의 뒤덮고 있는듯한 형상을 보인다. 일반적으로 수용액에서 pH가 5.0을 초과 하는 경우 알루미늄은 겔(gel) 형태의 수산화물로서 침전 될 수 있다. 또한 무전해 니켈 도금액은 니켈이온과 환원 제의 자발적인 분해반응을 통해 니켈입자나 인화니켈 (nickel phosphide)이 생성될 수 있다. 이런 미세한 고체입 자들은 표면적이 크기 때문에 매우 효율적인 촉매로서 작 용하여 자가가속연쇄반응(self-accelerating chain reaction)을 일으켜 도금용액 내 부산물로서 생성되어 침전된다[14]. 말 레산이나 싸이오요소(thiourea)는 고체 촉매표면에 흡착되 어 부 반응을 억제하고 니켈 도금액을 안정화 시킬 수 있 다. 즉, Np-F는 그림 3(j)에 나타낸 바와 같이 안정제의 첨 가로 부 반응을 억제함으로써 알루미늄 표면에서 니켈입 자 형성을 촉진시킨 결과이다.
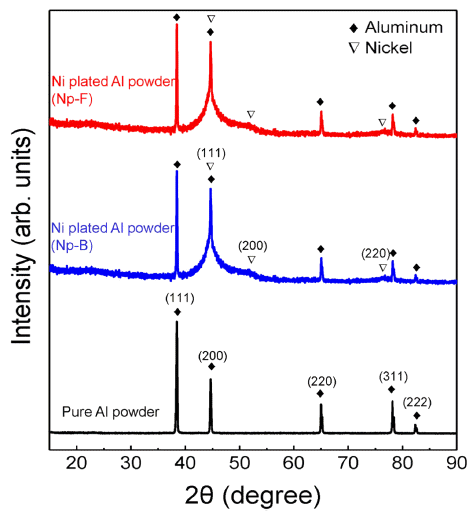
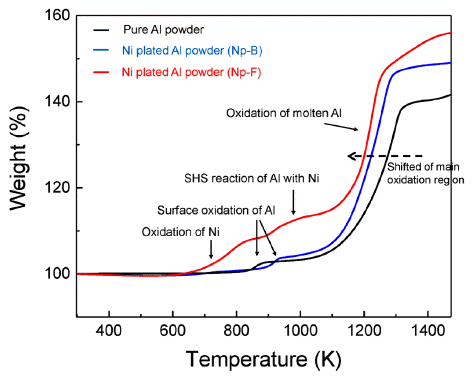
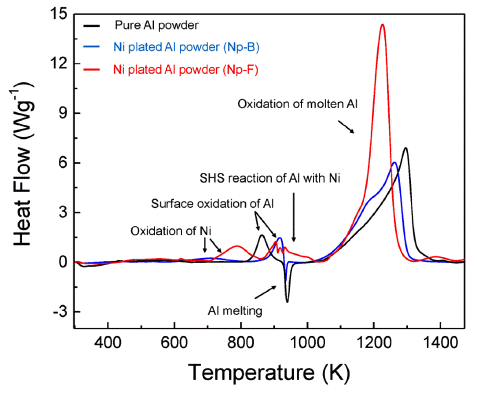
- 그림 4는 순수 알루미늄과 Np-B, Np-F 알루미늄 분말 의 XRD 패턴 분석 결과이다. 순수 알루미늄의 피크와 비 교하였을 때, 도금된 알루미늄 분말에서 니켈 고유의 X- 선 회절 패턴이 분석되었고 이를 통해 알루미늄 분말 표 면에 니켈이 도금되었음을 확인하였다. 그리고 순수 알루 미늄 분말과 Np-B, Np-F 분말의 TGA와 DSC 분석 결과 를 그림 5과 그림 6에 나타내었다. 그림 5에서 보여지듯 이 순수 알루미늄 분말은 약 880K와 1200K에서 무게증가 가 관찰되며, 이는 각 온도에서 알루미늄의 표면산화와 용 융된 알루미늄의 산화반응으로 해석된다. Np-B는 순수 알 루미늄과 비슷한 거동을 보여주지만 표면 산화가 약 920K에서 일어나고 용융 알루미늄의 산화반응이 더욱 저 온에서부터 시작한다는 것을 확인할 수 있다. Np-F의 경 우 저온에서부터 확연히 다른 결과를 보여주고 있다. 600K 이후 시작되는 무게증가는 도금된 니켈의 산화반응 이고 약 920K에서 알루미늄의 표면산화가 관찰되며, 980K 부근에서 무게 변화는 알루미늄이 녹기 시작하면서 접촉되어 있는 니켈과의 SHS 반응일 것이라 예상된다. 마 지막으로 1200K 부근의 알루미늄 산화반응은 순수 알루 미늄이나 Np-B보다 먼저 일어남을 보여준다. 이 결과는 알루미늄 표면의 흡착 니켈입자가 증가함에 따라 SHS 반 응으로 인하여 점화성을 향상 시킬 수 있음을 보여준다.
- 그림 6의 DSC 결과에서는 650-850K에서 Np-B와 Np-F 의 니켈산화물 생성에 의한 발열피크를 확인 할 수 있으 며, 알루미늄 표면의 니켈 흡착에 의해 표면 산화반응이 순수알루미늄보다 늦게 일어남을 볼 수 있다. 무엇보다 Np-F에서 알루미늄의 용융점 이후 SHS 반응으로 인한 발 열피크를 명확히 확인 할 수 있다. 1100-1300K 온도 구간 에서 용융 알루미늄의 산화에 의한 반응은 Np-F > Np- B > pure Al 순서로 일어남을 보인다. 또한, 실험에 사용된 순수한 알루미늄의 발열에너지(exothermic reaction enthalpy, -ΔH)는 약 4.85 kJg-1로, 니켈 나노입자가 정밀하게 코팅된 Np-F 분말은 같은 구간에서 약 2배 이상의 발열 엔탈피 값 을 가질 것으로 예상된다.
결과 및 고찰
Fig. 3

(a−f) SEM images of nickel plated aluminum powders according to each condition and (g−j) schematic illustrations for mechanism of nickel formation; (a) initial condition (Np-A), (b) reductant (Np-B), (c) complexing agent (Np-C), (d) pH value (Np−D), (e) reductant and pH value (Np−E), (f) reductant, stabilizer and pH value (Np−F).

- 본 연구에서는 고반응성 미세 알루미늄 분말의 니켈 코 팅을 위해 무전해 니켈 도금법을 이용하였으며, 니켈 도금 액의 구성성분이 니켈입자의 형성과 흡착 특성에 미치는 영향을 확인하였다. 극미세 알루미늄 분말에 대한 니켈 도 금에 있어 먼저 고려되어야 할 사항은 형성되는 니켈 입 자의 크기이며, 환원제 및 pH로 제어될 수 있음을 확인하 였다. 이와 관련해서 적절한 농도의 착화제를 사용함으로 써 핵 형성된 니켈의 성장 속도를 조절 할 수 있음을 확 인하였다. 또한 안정제의 첨가로 촉매로써 작용하는 콜로 이드 및 고체 부유입자의 부반응을 최소화하여 알루미늄 표면에서의 니켈입자 성장을 촉진시킬 수 있음이 확인되 었다.
- 각 공정조건 별로 합성된 니켈입자 흡착된 알루미늄 분 말은 열 분석 결과를 통해 니켈의 코팅이 알루미늄 표면 전체에 대하여 이루어질수록 빠르고 높은 발열반응이 나 타남을 확인하였다. 더불어, 발열반응의 양적인 측면에서 도 알루미늄의 SHS 반응에 의해 추가적인 점화 촉진 효 과 및 반응성 향상 가능성이 있음을 확인할 수 있었다.
결 론
-
Acknowledgements
- 본 논문은 국방과학연구소(ADD) 개별기초과제 ‘고반응 성 금속 분말 산화 억제 연구’(계약번호: UD160008GD)의 지원과 재료연구소 주요사업 ‘계면재단형 3D 프린팅 소재 기술 개발’의 지원으로 작성되었습니다.
감사의 글
- 1. K.T. Kim, D.W. Kim, C.K. Kim and Y.J. Choi: Mater. Lett., (2016) 167 262.Article
- 2. X. Guo, X. Li, H. Li, D. Zhang, C. Lai and W. Li: Surf. Coat. Tech., (2015) 265 83.Article
- 3. S. Lee, J. Lim, K. Noh and W. Yoon: J. of KSPE., (2014) 18 9.Article
- 4. R.A. Yetter, G.A. Risha and S.F. Son: Proc. Combust. Inst., (2009) 32 1819.Article
- 5. M.L. Pantoya and S.W. Dean: Thermochim. Acta., (2009) 493 109.Article
- 6. N.A. Clayton and S. Keerti and et al: ACS Appl. Mater. Interfaces., (2014) 6 6049.Article
- 7. J. McCollum, M.L. Pantoya and S.T. Iacono: ACS Appl. Mater. Interfaces., (2015) 7 18742.Article
- 8. V. Rosenband and A. Gany: Int. J. Energ. mater. Chem. Propul.., (2010) 10 42.
- 9. T.J. Foley, C.E. Johnson and K.T. Higa: Chem. Mater., (2005) 17 4086.Article
- 10. C. Yang: Appl. Phys., A Mater. Sci. Process., (2014) 114 459.ArticlePDF
- 11. Y. Yavor, V. Rosenband and A. Gany: Int. J. Energ. mater. Chem. Propul., (2010) 9 477.Article
- 12. S.L. Vummidi, Y. Aly, M. Schoenitz and E.L. Dreizin: J. Propuls. Power., (2010) 26 454.Article
- 13. K.T. Kim, D.W. Kim, S.H. Kim, C.K. Kim and Y.J. Choi: Appl. Surf. Sci., (2016.Article
- 14. G.O. Mallory, In : J.B. Hajdu, editor. Electroless Plating: Fundamentals and Applications, (1990) Orlando, Florida AESFS, 3.
Figure & Data
References
Citations
Citations to this article as recorded by 

- Synthesis and oxidation behavior of Al@Ni-Fe core-shell energetic composite powders
Khawar Yaqoob, Asifa Kusar, Amena Mohsin, Onur Ertuğrul, Ahmet Çağrı Kılınç, Fahad Ali, Rub Nawaz Shahid, Naeem ul Haq Tariq, Hassan Wahab, Hasan Bin Awais
Energetic Materials Frontiers.2025;[Epub] CrossRef - Study Progress in Improving the Energy Release Rate of Al Powders
永鹏 陈
Material Sciences.2024; 14(08): 1178. CrossRef - Study on the Combustion Characteristics of Ethanol Nanofuel
Kwanyoung Noh, Hyemin Kim, Siwook Nam, Soonho Song
Aerospace.2023; 10(10): 878. CrossRef - The Self-Reduction during the Thermal Decomposition of an Ammonium Molybdate
Kyoungkeun Yoo, Won Beom Koo, Hanggoo Kim, Sang-hun Lee
Minerals.2023; 13(2): 133. CrossRef - Increased exothermic reactivity of polytetrafluoroethylene-coated aluminum powders: Impact of powder size reduction
Soo-ho Jung, Kyung Tae Kim, Jinhee Bae, Yoon Jeong Choi, Jae Min Kim, Jeong-Yun Sun
Materials Letters.2023; 351: 135009. CrossRef - High energy Al@Ni preparation of core-shell particles by adjusting nickel layer thickness
Yongpeng Chen, Jianguo Zhang, Jiawei Zhu, Ning Xiang, Huichao Zhang, Zunning Zhou
Vacuum.2022; 205: 111344. CrossRef - Electroless deposition of Ni nanoparticles on micron-sized boron carbide particles: Physicochemical and oxidation properties
Prashant Ravasaheb Deshmukh, Hyung Soo Hyun, Youngku Sohn, Weon Gyu Shin
Korean Journal of Chemical Engineering.2020; 37(3): 546. CrossRef - Synthesis and exothermic reactions of ultra-fine snowman-shaped particles with directly bonded Ni/Al interfaces
Gu Hyun Kwon, Kyung Tae Kim, Dong Won Kim, Jungho Choe, Jung Yeul Yun, Jong-Man Kim
Applied Surface Science.2019; 476: 481. CrossRef
Synthesis of Nickel Nanoparticle-adsorbed Aluminum Powders for Energetic Applications



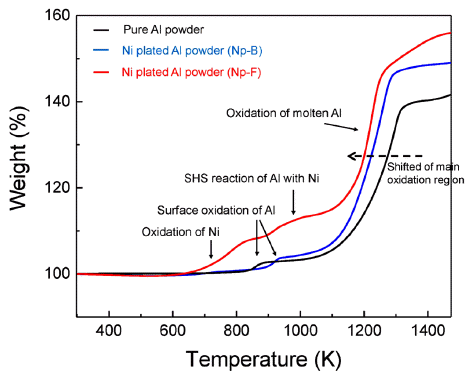
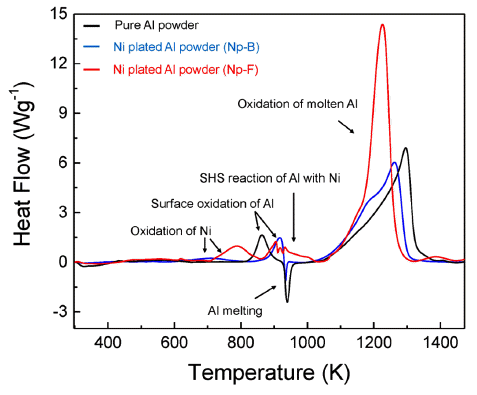
Fig. 1
A schematic diagram of Pre-treatment and electroless nickel plating process.
Fig. 2
SEM images and cross-sectional TEM images of the pure aluminum particles.
Fig. 3
(a−f) SEM images of nickel plated aluminum powders according to each condition and (g−j) schematic illustrations for mechanism of nickel formation; (a) initial condition (Np-A), (b) reductant (Np-B), (c) complexing agent (Np-C), (d) pH value (Np−D), (e) reductant and pH value (Np−E), (f) reductant, stabilizer and pH value (Np−F).
Fig. 4
XRD patterns of the pure aluminum and Ni plated aluminum powders (Np-B and Np-F).
Fig. 5
TGA curves of the Ni plated aluminum powders compared with pure aluminum powders.
Fig. 6
DSC curves of the Ni plated aluminum powders compared with pure aluminum powders.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Synthesis of Nickel Nanoparticle-adsorbed Aluminum Powders for Energetic Applications
| Entry | Ni source (NiSO4) | Reductant (NaH2PO2) | Complexing agent (sodium citrate) | Stabilizer (maleic acid) | pH controller | pH | Temperature, Time |
|---|---|---|---|---|---|---|---|
|
|
|||||||
| Np-A (initial conditions) | 0.02 mol | 0.03 mol | 0.03 mol | × | × | 6.56 | 45°C, 30 min |
| Np-B (reductant ↑) | 0.02 mol | 0.12 mol | 0.03 mol | × | × | 6.85 | 45°C, 30 min |
| Np-C (complexing↑) | 0.02 mol | 0.03 mol | 0.01 mol | × | × | 6.98 | 45°C, 30 min |
| Np-D (pH value↑) | 0.02 mol | 0.03 mol | 0.03 mol | × | NH4OH | 8.94 | 45°C, 30 min |
| Np-E (Np B + pH↑) | 0.02 mol | 0.12 mol | 0.03 mol | × | NH4OH | 9.04 | 45°C, 30 min |
| Np-F (Np E + stabillizer) | 0.02 mol | 0.12 mol | 0.03 mol | 0.1 mg | NH4OH | 9.08 | 45°C, 30 min |
Table 1
Composition of the electroless nickel plating solution used in the experiment.
Table 1
TOP
 KPMI
KPMI


 Cite this Article
Cite this Article