Articles
- Page Path
- HOME > J Powder Mater > Volume 32(2); 2025 > Article
-
Research Article
백운석에서 MgSO4의 추출과 간수에서 Mg(OH)2 합성 연구 - 심현승1, 김지연1, 최아름1,2, 오누리2, 김유진1,*
- Extraction of MgSO4 from dolomite and synthesis of Mg(OH)2 in Bittern
- HyunSeung Shim1, Jiyeon Kim1, Areum Choi1,2, Nuri Oh2, YooJin Kim1,*
-
Journal of Powder Materials 2025;32(2):122-130.
DOI: https://doi.org/10.4150/jpm.2025.00073
Published online: April 30, 2025
1한국세라믹기술원 엔지니어링 소재 센터
2한양대학교 신소재 공학과
1Engineering Materials Center, Korea Institute of Ceramic Engineering and Technology, Icheon, Republic of Korea
2Division of Materials Science & Engineering, Hanyang University, Seoul, Republic of Korea
- *Corresponding author: YooJin Kim TEL: +82-31-645-1427 FAX: +82-31-645-1485 E-mail: yjkim@kicet.re.kr
© The Korean Powder Metallurgy & Materials Institute
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 950 Views
- 33 Download
- 1 Crossref
Abstract
- Synthesis of high-purity magnesium hydroxide using dolomite and bittern is important for use in various applications. We synthesized magnesium hydroxide using bittern and dolomite, which are domestic resources. In Bittern, there is a high concentration of Mg2+ ions, but the impurity Ca2+ ion content is also significant, requiring a purification process to remove it. There are two main methods for this purification. Firstly, there is a separation method that utilizes the difference in solubility between Mg2+ ions and Ca2+ ions by using sulfuric acid on dolomite. Adding MgSO4 solution from dolomite to Bittern removes Ca2+ ions as CaSO4. This process simultaneously purifies Ca impurities and increases the Mg/Ca ratio by adding extra Mg2+ ions. In this study, purified bittern was obtained by using dolomite and sulfuric acid to extract MgSO4, which was then used to purify Ca2+ ions. High-purity Mg(OH)2 was synthesized by optimizing the NaOH and NH4OH ratio as an alkaline precipitant. Mg(OH)2 synthesis technology made by effectively removing Ca ions from dolomite and bittern can contribute to domestic pilot production.
- 수산화마그네슘(Mg(OH)2)은 방열 소재와 제약 산업의 원료로 사용되는 무기 재료이며, 연소 시 수화물이 탈수화되면서 흡열반응이 일어나기 때문에 난연제로서 주목받는 물질이다. [1-3]. Mg 원료는 해수와 광물로부터 소성, 화학적 에칭, 침전법 등의 방법을 통해 추출할 수 있다[4, 5]. 먼저 광물 추출원료로는 Magnesite(MgCO3)와 Dolomite (백운석, (CaMg(CO3)2)) 등이 있다. 백운석은 우리나라에서 채굴할 수 있는 비금속 광물자원으로 내화재, 유리, 충전재 등으로 사용되고 있으며, 화학성분은 CaCO3와 MgCO3가 약 1대 1의 비율로 포함되어 있다[1, 6]. 따라서 백운석 내 Mg2+ 성분을 이용하기 위해서 높은 비율의 Ca2+ 함량을 제어하는 것이 중요하다. 광물자원의 경우 산을 이용한 에칭 방법이 일반적이기 때문에 산이면서 황산염에 대한 용해도 차이를 이용할 수 있는 H2SO4를 이용하여 Mg2+ 을 추출하고자 한다. 이는 정제 및 침전을 동시에 진행시켜 Mg(OH)2를 얻을 수 있으나, 백운석에 포함된 Si, Fe이온 등의 불순물 이온 등에 의해 고순도 Mg(OH)2를 얻기 힘들다. 불순물들이 포함 되어있는 Mg(OH)2는 다양한 응용범위 적용이 힘들기 때문에, 이에 가용자원을 이용한 98-99%의 고순도 Mg(OH)2 의 합성 및 정제기술이 산업에 필요하다. 다른 Mg 공급원인 해수는 Cl-과 Na+ 이온이 가장 많이 포함되어있고 Mg2+ 이온의 함량이 적기 때문에 경제적인 공정 개발과 낮은 순도 문제의 해결이 필요하다[7]. 반면에 간수는 해수에서 이온교환막을 통해 Na+ 이온을 일부 제거한 용액이며, 해수에 비해 Mg2+ 이온이 농축되어 있지만 Ca2+ 이온 비율이 해수보다 상대적으로 높아 정제가 필요하다. 이러한 Ca2+ 이온을 제거하는 방법으로는 SO42-을 첨가하여, 간수 내 Ca2+ 이온을 SO42-이온과 반응시켜 이수석고 (CaSO4•2H2O)로 침전시켜 제거할 수 있다[4]. 이후 Ca2+이 제거된 간수에 염기성 침전제 (NH4OH, NaOH 등)를 첨가해 Mg(OH)2를 얻을 수 있다[7]. 간수 내의 Mg2+과 Ca2+은 결정화에 있어 pH의 영향을 받는데, 이 두 물질의 침전되는 pH가 다르므로 공정 간 적정 pH의 최적화와 유지가 Mg(OH)2 순도에 있어 중요한 요소이다[8].
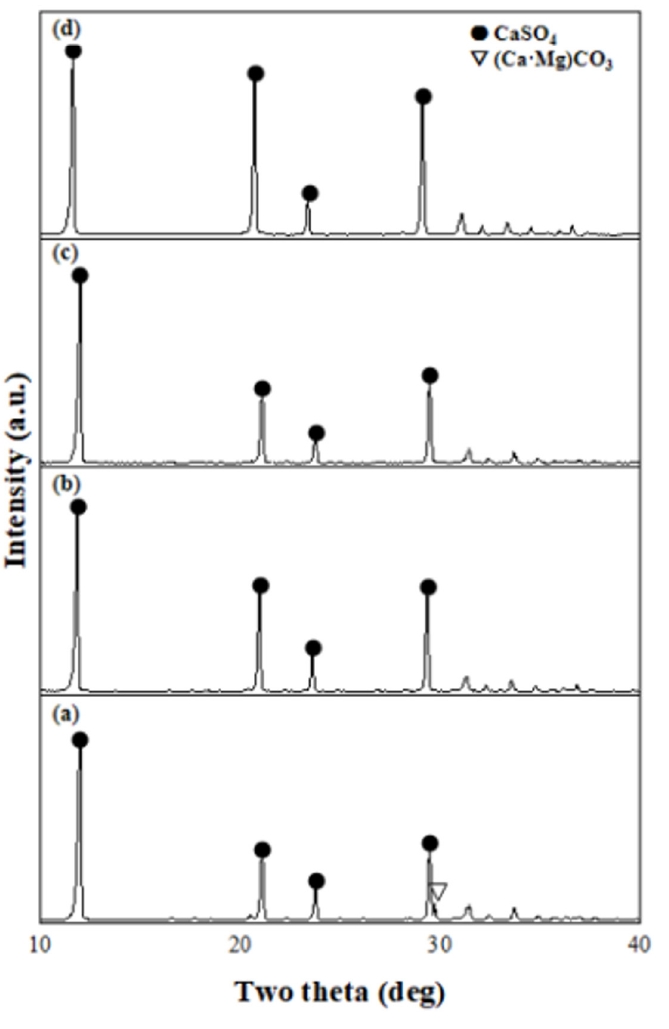
- 이번 연구는 Mg2+ 이온 전구체로 백운석과 간수를 이용해 효율적으로 Mg2+ 추출 및 Ca2+ 제거하여 고순도의 Mg(OH)2 합성하는 연구를 진행하였다. 백운석과 H2SO4를 이용하여 추출된 MgSO4를 간수에 첨가하여 물에 대한 용해도가 낮은 CaSO4를 침전시켜 (Bittern + MgSO4 → MgCl2 + CaSO4·2H2O↓) Ca2+ 불순물을 정제하였다. 간수에 백운석에서 추출된 MgSO4를 첨가하면 H2SO4을 첨가할 때 보다 높은 pH 유지를 통해 염기성 침전제 사용량을 줄일 수 있으며, 간수의 Mg2+ 이온 함량을 증가시켜 물질의 순도 증가에 기여할 수 있다.
1. Introduction
- 2.1 재료 및 분석기기
- 백운석은 D사에서 공급받아 괴상의 백운석을 디스크 밀(Pulversette 12, Fritsch, Germany)을 이용해 디스크 간격을 조절하며 입자 크기를 조절하였고, 이를 Particle Size Analysis (PSA, LA-950V2, Horiba, Japan)분석을 통해 확인하였다. 정제염 간수는 성분 및 이온 함량을 분석하기 위해 H사에서 공급받아 사용하였다. H2SO4 (대정화금, 95 %)는 증류수를 이용해 다양한 농도로 묽혀서 사용하였다. 침전공정에 사용된 시약은 NaOH (덕산화학, 50 %)와 NH4OH (덕산화학, 28 %)를 사용하였다. 원료와 합성된 결과물은 X-ray diffraction (XRD, Model D/Max 2500, Rigaku, Japan)을 통해 Cu-Kα radiation(λ = 1.5406 Å)으로 10 ° - 80 °의 2θ 범위에서 4° min-1 의 주사율로 결정상을 분석하였으며, X-ray fluorescence (XRF, Model S1 TITAN, Bruker, USA) 와 Inductively Coupled Plasma Optical Emission Spectrometry (ICP-OES, Model SPECTRO ARCOS, Thermo Fisher Scientific, USA) 로 성분을 분석하였고 Transmission Electron Microscope (TEM, Model CM 200, Philips, Netherlands)을 통해 형상을 평가하였다.
- 2.2 H2SO4을 이용한 백운석 내 Ca2+ 제거 및 MgSO4 추출
- 백운석의 성분 분석을 위하여 ICP 및 XRF 분석을 실시하였다. 분석 결과 백운석 내 Mg2+, Ca2+ 이 주성분을 이루고 있었고, Mg2+ 을 얻기 위해 Ca2+ 분리가 필요하다. 따라서 효율적인 Ca2+ 제거를 위하여 다음과 같은 실험을 진행하였다. 백운석과 H2SO4을 반응시키면 석고(CaSO4)형태가 고체 상태로 침전되어 백운석 내 Ca2+을 제거할 수 있다(1).
- 이는 물에 대한 CaSO4와 MgSO4의 용해도 차이를 이용한 방법으로 효율적인 MgSO4용액 생성을 위해 다양한 실험 조건에서 실험을 진행하였다. Table 1은 백운석에 H2SO4의 농도를 조절하여 반응시킨 실험 조건이다. 여러 가지 백운석 중 K사로부터 공급받은 괴상의 백운석을 사용하였다. 괴상의 백운석은 디스크밀(Pulversette 12, Fritsch, Germany)을 통해 100 μm 이하로 분쇄하여 분말 형태로 사용하였다.
- Condition Ⅰ (sample 1~3)에서는 최적의 Ca2+ 제거 효율을 나타내는 H2SO4 농도에 대해 찾고자 하였다. 백운석과 H2SO4의 몰비율을 1:2로 고정한 상태에서 가하는 H2SO4의 퍼센트 농도를 다르게 하여 실험을 진행하였다. 10 % H2SO4 용액을 이용하여 1, 5 % H2SO4 용액을 제조하고 이를 백운석 10 g에 가한 후 24시간 동안 교반하여 MgSO4 용액을 제조하였다.
- Condition Ⅱ (sample 4~6)에서는 최적의 Ca2+ 제거 효율을 나타내는 백운석과 H2SO4의 비율을 찾고자 하였다. H2SO4의 농도는 5 %로 고정하고 백운석의 양(5, 10, 15 g)을 조절하여 백운석과 H2SO4의 몰비율을 조절하였다. 이 후 24시간 동안 교반하여 MgSO4 용액을 제조하였다.
- Condition Ⅲ (sample 7~8)에서는 최적의 Ca2+ 제거 효율을 나타내는 백운석과 H2SO4의 반응시간을 찾고자 하였다. 백운석 10 g에 H2SO4 수용액 400 ml를 첨가하여 반응시간(2~24 h)을 조절하여 pH에 따른 Mg2+이온의 양을 확인하였다. 이 후 24시간 동안 교반하여 MgSO4 용액을 제조하였다.
- 1-8번 샘플 모두 교반속도300 rpm으로 교반하여 반응시키고 이후, 8000 rpm으로 10분간 원심분리 하였다. 원심분리를 통해 얻은 MgSO4 용액은 ICP-OES로 성분을 분석하였다.
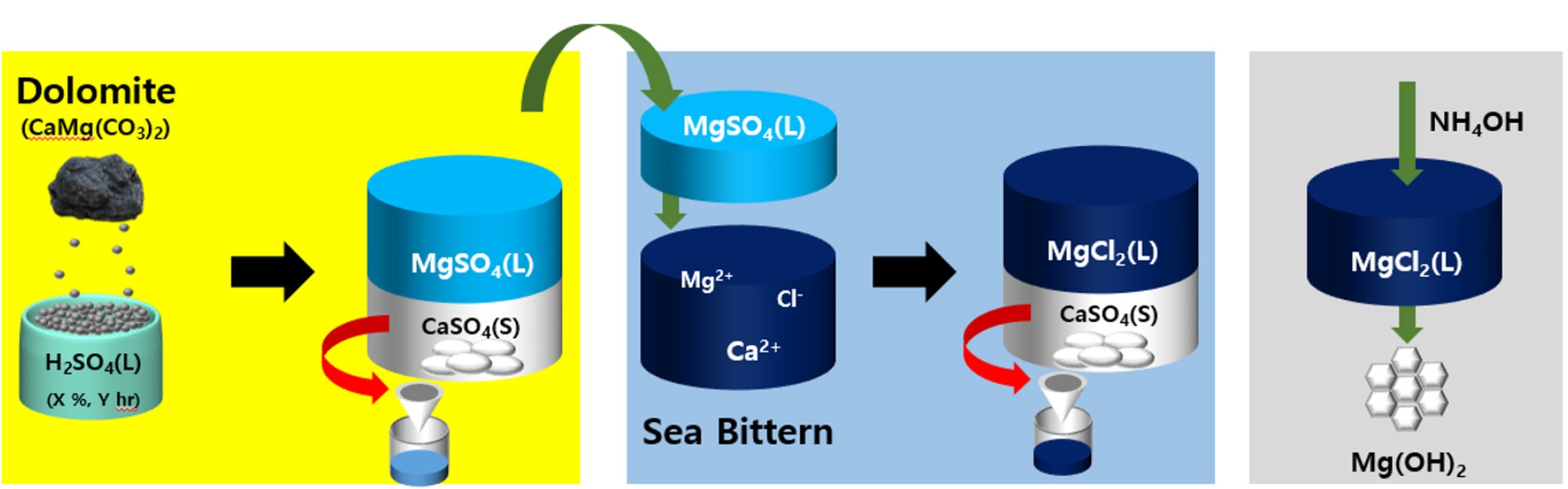
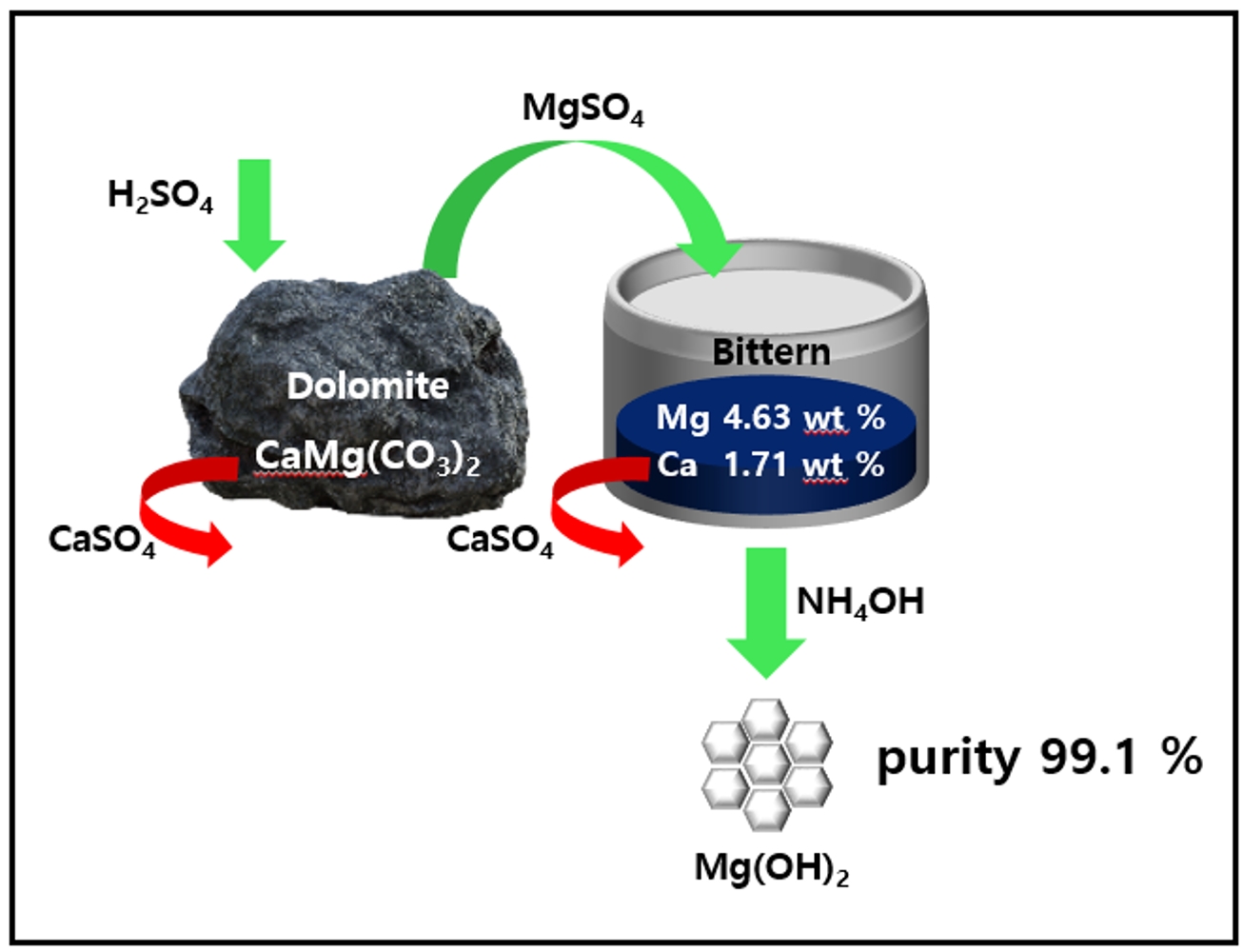
- Fig. 1은 백운석과 간수를 활용하여 고순도의 Mg(OH)2를 수득하는 과정의 모식도이다. 백운석과 간수에 포함 되어있는 Ca2+을 제거하기 위하여 첫번째로 분말 형태의 백운석을 H2SO4 용액에 넣고 CaSO4로 침전 시켜 백운석 내의 Ca2+ 을 제거하는 과정과, 두번째로 이후 얻어진 MgSO4 용액을 간수와 반응시켜 간수 내의 Ca2+을 CaSO4 형태로 침전 시켜 제거하는 과정이다. 마지막으로 얻어진 MgCl2 용액에 NH4OH를 첨가하여 Mg(OH)2를 수득하였다.
- 2.3 MgSO4을 이용한 간수 내 Ca2+ 정제
- 간수의 성분 분석을 위하여 ICP 및 XRF 분석을 실시하였다. 분석 결과 해수에 비해 높은 비율의 Mg2+, Ca2+ 이온이 존재하였고, Mg2+을 얻기 위한 Ca2+ 분리가 필요하다. 간수 중 Ca2+ 이온을 효율적으로 제거하기 위해 (H2SO4 및) MgSO4를 이용하였다. 간수 내 Mg/Ca 비율을 증가시켜 고순도 MgSO4를 제조하였다. 간수에 MgSO4를 첨가하게 되면 물에 대한 용해도가 낮은 CaSO4 (0.255/100 ml)는 침전되어 Ca2+ 성분을 감소시킬 수 있다[9] (2).
- 이때 사용한 MgSO4 용액은 앞선 실험에서 최적화한 방법으로, 5 %의 H2SO4와 백운석의 몰비율을 1:2로 4시간 교반하여 제조 후 간수와 반응시켜 CaSO4를 분리하여 디칼슘 간수를 제조하였다. 이를 간수에 첨가하여 300 rpm에서 2시간 동안 교반을 진행하였다. 이후 8000 rpm에서 10분간 원심분리하여 Ca2+이 정제된 간수를 제조하였다. Ca2+이 정제된 간수는 ICP로 성분을 분석하였다.
- 2.4 Ca2+이 정제된 간수에 염기성 침전제를 첨가하여 Mg(OH)2 제조
- Mg(OH)2는 간수에 염기성 침전제를 첨가하면 염기성 물질 내의 OH-이온이 간수 내의 Mg2+이온과 반응하여 Mg(OH)2의 형태로 침전된다(3).
- Mg(OH)2의 합성을 위해 Ca2+이 정제된 간수에 염기성 침전제인 NaOH와 NH4OH의 몰비율을 1:2로 하여 각각 투입 후 300 rpm에서 2시간동안 충분히 교반을 진행하였다. 반응이 끝난 생성물은 8000 rpm에서 10분간 원심분리하여 침전물을 얻었다. 침전물은 증류수를 사용하여 2회 세척을 하였다. 세척이 완료된 생성물은 80 °C 건조기에서 24시간 동안 건조 후 백색의 Mg(OH)2를 분말로 수득하였다. 수득한 Mg(OH)2는 XRD, ICP를 통해 성분을 분석하였다.
2. Experimental Section
- 3.1 백운석 성분 분석결과
- 괴상 상태의 백운석은 디스크밀을 이용하여 1 ㎛ 이하로 분쇄하였다. Table 2 은 분쇄된 백운석의 ICP 분석 결과이다. CaO는 30.5~30.9 wt%, MgO는 21.3~21.7 wt%로 백운석의 이론적 화학 조성과 비슷한 수치이다[10]. 4개의 회사로부터 공급받은 백운석에서 공통으로 소량의 금속산화물 불순물 SiO2, Al2O3, Fe2O3가 존재하였다. 이 중 D사 백운석의 금속산화물 불순물(SiO2, Al2O3, Fe2O3)들의 총합계는 0.3 wt%로 가장 낮게 측정된 것을 확인할 수 있었다. 따라서 고순도 Mg(OH)2 제조를 위한 MgSO4 용액 제조 실험에는 향후 제거가 어려운 SiO2 함량이 가장 적은 D사의 백운석을 사용하였다.
- 3.2 간수 성분 분석결과
- 간수는 해수를 이온교환막을 통과시켜 Na+를 일부 추출한 용액으로 Mg2+ 이온이 주성분이다. 간수의 성분을 알아보기 위하여 ICP 분석 및 이온 함량을 측정하였다. Table 3은 해수 및 간수의 이온 함량과 해수 대비 간수의 농도를 비교한 분석 결과이다. 분석 결과에 따르면, 간수는 Mg2+ 이온을 3.3 wt% 가지고 있으며, Ca2+, K+ 이온 등 다른 불순물 또한 다량으로 포함하는 것을 확인하였다. 이는 해수에 비해 Mg2+이온은 25.4배로 농축되어 있어 해수 대비 Mg2+ 이온을 효율적으로 추출이 가능하다. 하지만 Ca2+ 이온은 해수 대비 41.5배로 높은 비율로 존재하기 때문에 Ca2+를 효율적으로 제거해야 고순도의 Mg(OH)2을 얻을 수 있다.
- 3.3 백운석과 다양한 H2SO4의 농도에 따른 MgSO4용액 추출
- 백운석과 H2SO4의 화학반응을 통해 고체 상의 CaSO4를 제거하고 용액 상의MgSO4를 얻을 수 있다(4).
- 물에 대한 용해도가 낮은 CaSO4(0.255g/100 ml)는 침전되므로 Ca2+ 이온을 백운석과 H2SO4 용액으로부터 제거할 수 있다. 물에 대한 용해도가 상대적으로 높은 MgSO4 (35.1g/100 ml)는 용액 내 이온상태로 존재하므로 화학 반응에 이용하기 용이하다. 이를 간수 내 Mg2+ 이온의 농도를 증가시키기 위한 목적으로 사용할 수 있다.
- 백운석 내 Ca2+ 제거 후 고순도의 MgSO4 용액을 얻기 위해 H2SO4의 농도, 백운석과 H2SO4의 mol 비, 반응시간을 변화하여 3가지 실험을 진행하였다. Table 4는 H2SO4의 농도를 조절하여 얻은 MgSO4 용액의 ICP 결과이다. H2SO4의 농도에 따른 Mg2+ 이온 양과 불순물의 양을 확인하기 위해 해당 실험을 진행하였다. 1 M MgSO4를 얻기 위해 백운석: H2SO4을 1:2로, 24 hr 동안 반응시키고 필터를 이용하여 CaSO4를 제거하였다. H2SO4의 농도가 증가하면 모든 원소의 추출 량이 증가하는 것을 확인할 수 있었다. 이는 충분한 SO42- 이온이 Ca2+ 이온과 침전을 이루기 때문이다. 1 % H2SO4을 사용하는 경우, 분석한 전 원소에서 가장 낮은 원소 함량을 보였다. 이는 부족한 H2SO4이 백운석과 반응하지 않아 추출이 되지 않았고, 이는 충분한 H2SO4이 필요함을 보여준다.
- 또한 1 % H2SO4에 비해 5 % H2SO4을 사용하는 경우 Ca, Si등의 농도가 증가함을 확인할 수 있다. 이는 H2SO4의 양의 증가에 의해 백운석에 포함된 Ca, Si 등이 더욱 추출된 것으로 추정되며, 특히 Mg2+ 의 경우 다른 농도 샘플에 비해 약 1/3로 추출 효율이 크게 떨어지는 것을 관찰할 수 있었다. 5 %와 10 % H2SO4을 사용한 경우를 보면 두 농도에서 Mg2+ 추출 량은 비슷하나(3288 ppm, 3357 ppm) 10 % 농도를 사용한 경우 Ca와 Si를 비롯한 불순물의 추출이 소폭 증가함을 확인할 수 있었다. 그 결과, Mg/불순물 비율(Mg/Ca, Mg/Si)이 5 %에서 가장 높았다. 이는 H2SO4의 농도가 높아지면서 CaSO4의 용해도가 상승하기 때문이다[11], 따라서 Mg2+이온을 보충하기 위한 목적으로 5 % H2SO4 사용이 적합함을 확인할 수 있었다. 또한, 두 농도에서 황(S) 농도의 큰 차이는 5 % H2SO4만으로도 백운석 내 Ca2+ 제거에는 충분하다는 것을 뒷받침한다.
- 3.4 H2SO4과 백운석의 몰 비율 변화에 따른 MgSO4용액 추출
- 반응식 (5)는 백운석으로부터 MgSO4을 추출하고 Ca2+ 이온을 제거하기 위한 화학반응식이다.
- 이론적으로는 백운석과 H2SO4이 1:2의 비율로 반응한다. 그러나 백운석 내 불순물과 기타 환경적, 실험적 요인으로 인해 실제 반응비와는 차이가 존재한다. 따라서 H2SO4의 양을 조절하는 방식으로 백운석과 H2SO4의 비율을 변화시켜 MgSO4용액 내 Mg2+이온 양을 확인하였다. Table 5은 백운석과 H2SO4의 몰 비율을 조절하여 얻은 MgSO4 용액의 ICP 결과이다. 백운석에 5 % H2SO4을 첨가하여 24 hr 동안 반응시켰다. CaSO4는 필터를 이용하여 제거하였다. H2SO4을 과량 첨가한 경우(백운석과 H2SO4의 비율 1:4) 가장 낮은 농도의 Mg과 가장 높은 농도의 Ca과 Si 농도를 보였다. H2SO4양을 고정하고 백운석의 양을 5 g에서 10 g으로 늘렸을 때(백운석: H2SO4의 비율이 1:4에서 1:2로 변화할 때), MgSO4내 Mg2+ 의 농도도 2배가량 증가하는 것을 보아 해당 MgSO4 용액은 Mg2+포화상태임을 확인할 수 있다. 백운석과 H2SO4의 비율이 1:4일 때 낮은 Mg2+ 이온 대비 높은 금속 불순물 비를 얻었다. 백운석의 양이 10 g에서 15 g으로 증가한 경우, 추출된 Mg2+ 이온의 농도는 오히려 감소하였으며, Ca, Si, S의 농도는 증가함을 확인하였다. 이는 백운석과 H2SO4의 비율이 1:1.3인 경우는 해당 양의 백운석으로부터 Mg2+ 성분을 최대한으로 추출하기에는 황산 이온의 농도가 부족하다고 해석할 수 있다. 또한, 반응에 사용된 백운석 양의 증가 대비 Ca 농도는 소폭 증가한 것을 보아 Ca2+ 이온 제거에도 충분하지 않았다고 할 수 있다. 그 결과 Mg 대비 금속 불순물의 비율(Mg/Ca, Mg/Si)은 감소하였다. 따라서 백운석과 H2SO4의 비율이 1:2가 되도록 반응시키는 것이 Ca2+을 비롯한 불순물 함량을 최소화하는 최적의 MgSO4 용액 추출 반응 비율이라고 여겨진다.
- 3.5 H2SO4과 백운석의 반응시간에 따른 MgSO4용액 추출
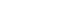
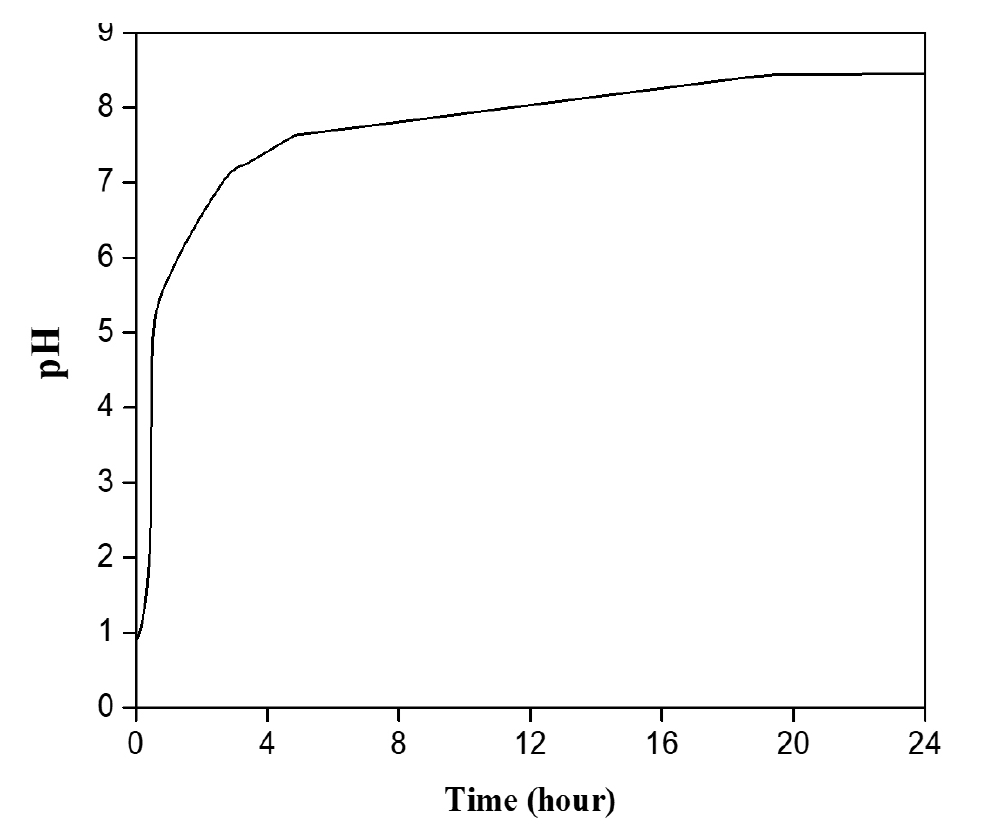
- H2SO4 용액이 들어있는 비커에 백운석 분말을 넣어 교반을 진행하였다. 일반적으로 반응시간이 길어질수록 생성물로의 전환율은 증가하나, 반응시간의 증가는 생산성 저하로 이어진다. 따라서 pH와 ICP를 통한 원소 농도분석을 통해 MgSO4용액 추출에 필요한 최적의 반응(교반)시간을 도출하고자 한다. Fig. 2는 H2SO4과 백운석의 교반 시간에 따른 pH 변화 그래프이다. MgSO4와 CaSO4는 약 염기성을 띠므로 반응하면서 pH가 증가하는 것을 확인할 수 있었다. 반응시간이 증가함에 따라 pH는 1시간에서 1시간 30분까지 급격히 증가하였고, 4시간 이후 pH는 7.1로 일정하게 유지되며, 이는 중성영역 범위에 해당한다. 따라서 MgSO4 용액은 중성을 띠며, 4시간 교반 시 대부분의 반응이 진행된 것을 확인할 수 있다. Table 6은 교반 시간을 조절하여 얻은 MgSO4 용액의 ICP 결과이다. 반응 결과 생성된 CaSO4는 필터를 이용하여 제거하였다. 반응시간이 2시간에서 24시간으로 증가함에 따라 Si 농도가 증가하였다. 이외의 원소의 경우 교반 2시간 이후 추출된 원소의 농도에 큰 차이가 없다고 판단하였다. Mg/Si 비를 고려하면 2시간 반응하는 것이 최적의 반응시간이나 백운석 내 Si 함량보다 Ca2+ 의 함량이 훨씬 높아 Mg2+ 의 선택도를 떨어트리는 가장 큰 방해 요인이므로, Mg/Ca의 비율이 가장 높고, 반응시간에 따른 경제성을 고려한 4시간이 최적의 반응 시간이라고 판단된다. 반응교반 시간에 따른 생성물의 XRD 분석 결과를 Fig. 3에 나타내었다. 교반 시간이 2시간일 경우 아직 백운석(JCPDS 83-1530)이 용해되지 않아 남아있는 것을 XRD peak를 통해 확인할 수 있다. 교반 시간이 4시간 이상부터 백운석의 XRD peak가 사라지고 CaSO4(JCPDS 37-1496) peak만 존재하는 것을 보아 백운석이 완전히 분해된 것을 확인하였다. 그러나 교반 시간이 증가할수록 불순물 함량이 증가하기 시작하였다. 다양한 실험 변수들을 고려하였을 때 백운석과 H2SO4을 4시간 교반 하는 경우가 최적의 MgSO4 용액을 추출하는 조건이라고 판단된다.
- 3.6 MgSO4을 이용한 간수 내 Ca2+ 정제
- 간수 내 Ca2+ 이온을 제거하기 위해 물에 대한 CaSO4과 MgSO4의 용해도 차이를 이용하고자 한다. CaSO4 (0.255/100 ml)에 비해 높은 MgSO4(35.1g/100 ml)의 용해도는 Ca2+ 이온은 CaSO4고체로 침전되고, Mg 성분은 용액 내 이온 상태로 존재하게 하여 Mg2+과 Ca2+ 이온의 효율적인 분리가 가능하게 한다. MgSO4을 간수의 황산 이온의 공급원으로 사용하는 경우 Mg(OH)2 전구체인 간수 내 Mg2+ 함량을 높이는 동시에 Ca2+ 함량을 줄일 수 있다. 또한 중성에 해당하는 MgSO4의 pH는 후속공정에서의 pH조절을 통한 Mg(OH)2 생성 시 불필요한 염기성 침전제 사용량을 줄일 수 있다. 위와 같은 이유로 (6)과 같이 간수에 H2SO4을 가하지 않고 (7)과 같이 간수에 MgSO4용액을 가하여 간수 내 Ca2+을 정제하고자 하였다.
- Table 7은 Ca2+을 정제한 간수(디칼슘 간수)와 Ca2+을 정제하지 않은 간수의 ICP 결과이다. MgSO4 용액은 5 %의 H2SO4용액을 사용하였으며, 백운석과 H2SO4의 몰비율이 1:2가 되도록 4시간동안 교반 반응 시켜 제조 하였다. 이후 제조한 MgSO4를 간수와 반응시켜 생성된 CaSO4를 분리하여 디칼슘 간수를 제조하였다. 실험 결과 Mg2+이온은 4.63에서 5.65로 증가한 반면, Ca2+이온은 1.71에서 0.03으로 급격히 감소하였다.
- 3.7 Ca2+이 정제된 간수에 염기성 침전제를 첨가하여 Mg(OH)2 제조
- 디칼슘 간수에 염기성 침전제를 첨가하면 염기성 물질 내의 OH-이온이 간수 내의 Mg2+이온과 결합하여 Mg(OH)2의 형태로 침전된다. Mg(OH)2는 50℃ 이하에서 pH가 10.5~11.5 사이일 때 침전이 잘 일어나는 것을 확인할 수 있다[12]. 고순도의 Mg(OH)2를 제조하기 위해서는 용액의 pH가 9.5~12.5 범위 내에서 합성해야 한다[7]. 분말 평가를 위해 디칼슘 간수와 염기성 침전제(NaOH와 NH4OH)의 반응 비를 1:2로 하여 Mg(OH)2를 합성하였다(8-1, 8-2).
- Table 8는 디칼슘 간수와 NH4OH를 이용하여 합성한 Mg(OH)2의 ICP 결과이다. 염기성 침전제로 NaOH를 첨가한 샘플의 용액 pH는 13.8, NH4OH를 첨가한 샘플의 pH는 11로 측정되었다. 간수에 녹아 있는 중탄산 이온과 백운석, H2SO4 반응 후 분해된 CO2가 물속에 녹아 잔존 Ca2+이온이 Ca(HCO3)2로 존재한다. 간수에 NaOH를 가하는 경우 용액 pH는 13.8로 Ca2+ 이온이 CaCO3로 침전된다(9).
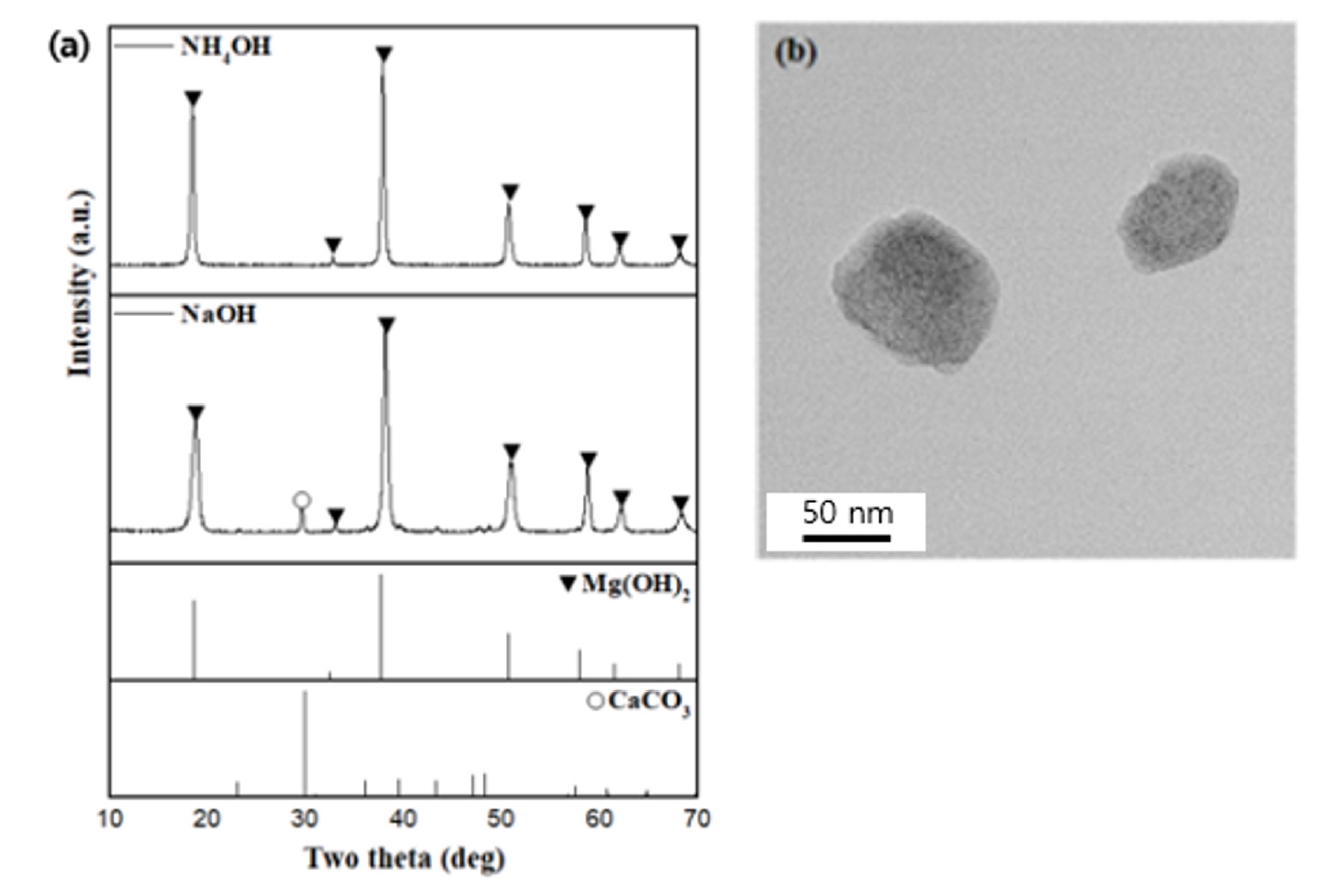
- 따라서 간수에 NaOH를 가하는 경우 탄산칼슘(CaCO3)등의 Ca2+가 포함된 불순물 또한 같이 침전되어 96 %의 낮은 Mg(OH)2 순도를 보인다. 그러나 NH4OH를 이용하여 합성한 경우, 99.1 %의 고순도 Mg(OH)2 가 합성된 것을 확인할 수 있다. 이러한 실험 결과는 Fig. 4의 XRD 결과에서도 잘 드러난다. NaOH를 이용하여 합성한 경우 CaCO3(JCPDS 05-0586)의 peak가 관찰된 반면, NH4OH를 이용하여 합성한 경우에서는 XRD 분석 결과 Mg(OH)2 (JCPDS 44-1482) peak만이 존재함을 확인할 수 있었다. 따라서 간수를 이용한 Mg(OH)2 제조 과정에서 염기성 침전제로 약염기인 NH4OH를 사용하여 pH를 11이하로 유지하고, Ca(OH)2 생성을 억제하고 고순도 Mg(OH)2를 얻을 수 있다.
3. Results and Discussion
- 국내 자원인 백운석과 간수를 이용해 50 nm 급 Mg(OH)2를 합성을 진행하였다. 본 연구에 사용되는 백운석과 간수에는 Ca2+ 이온이 공통으로 다량 존재하며, 효율적인 Ca2+ 이온을 제거하기 위해 H2SO4을 활용해 CaSO4를 침전 시킬 수 있다. 백운석에 H2SO4을 가해 Ca2+이 제거된 고순도 MgSO4 용액을 제조하였다. 이는 CaSO4와 MgSO4의 물에 대한 용해도 차이를 이용한 방법으로 고순도의 MgSO4 용액은 5 % 의 H2SO4을 이용하여 백운석과 H2SO4의 반응비가 1:2 일 때 얻을 수 있었다. MgSO4 용액의 pH는 반응시간 4시간 이후부터 pH가 7.1로 일정하게 유지되며, Mg, Ca 및 S 이온의 양은 반응 시간에 큰 영향을 받지 않는 것을 확인하였다. Ca2+ 이온이 제거된 MgSO4는 간수의 Ca2+를 제거하는데 사용되며, 간수에 MgSO4를 첨가하는 경우 Ca2+ 제거와 간수 속 Mg2+ 농도가 증가하며, 후속공정에서의 pH 조절을 위한 염기성 침전제의 양을 줄일 수 있다. 앞선 실험을 통해 최적의 MgSO4 용액 추출 조건을 바탕으로 제조한 MgSO4 용액을 이용하여 간수 내 Ca2+ 이온을 CaSO4 형태로 제거하였다. 그 결과 Ca2+ 이온은 약 98 % 제거되었으며, 마지막으로 간수에서 Ca2+ 이온을 제거한 MgCl2 용액에 염기성 침전제를 가해 육각판상형태의 Mg(OH)2 (크기 약 50 nm)을 얻었다. 고순도의 Mg(OH)2가 합성되는 pH 조건은 MgCl2 용액에 염기성 침전제를 첨가하여 확인하였다. 약염기인 NH4OH를 이용하였을 때 pH가 11로 순도 99.1 %의 Mg(OH)2를 얻을 수 있었다. 국내 자원인 백운석, 간수에서 Ca2+ 이온의 효율적 제거를 통해 고순도 육각판상 형태의 Mg(OH)2 을 얻었다.
4. Conclusion
-
Funding
This work was supported by a grant from “A pilot project for domestic production of magnesium based ceramic raw material” (20016812) funded by the Ministry of Trade, Industry and Energy (MOTIE), Republic of Korea.
-
Conflict of Interest
The authors declare no conflict of interest.
-
Data Availability Statement
All dataset files used in this study can be available on request.
-
Author Information and Contribution
HyunSeung Shim: researcher; validation, writing–review & editing. Jiyeon Kim: researcher; Investigation, writing–original & draft. Areum Choi: Master’s degree student; Investigation, Data curation. Nuri Oh: professor; supervision. YooJin Kim: chief researcher; writing–original draft, funding acquisition, project administration, supervision.
-
Acknowledgments
None.
Article information
| Sample |
Component (wt %) |
|||||
|---|---|---|---|---|---|---|
| Cl- | SO42- | Ca2+ | Mg2+ | K+ | Na+ | |
| Sea water | 1.93 | 0.27 | 0.04 | 0.13 | 0.04 | 1.07 |
| Sea bittern | 16.82 | 0.006 | 1.66 | 3.30 | 4.21 | 2.65 |
| Sea bittern/Sea water | 8.72 | 0.02 | 41.5 | 25.4 | 105 | 2.48 |
| Sample (H2SO4) |
Component (ppm) |
Ratio (%) |
||||
|---|---|---|---|---|---|---|
| Mg | Ca | Si | S | Mg/Si | Mg/Ca | |
| 1 % | 1304 | 529.8 | 5 | 2001 | 260.8 | 2.46 |
| 5 % | 3288 | 651.2 | 8.6 | 12110 | 382.3 | 5.05 |
| 10 % | 3357 | 703.4 | 9.1 | 33310 | 368.9 | 4.77 |
| Sample (Dolimite:H2SO4) |
Component (ppm) |
Ratio (%) |
||||
|---|---|---|---|---|---|---|
| Mg | Ca | Si | S | Mg/Si | Mg/Ca | |
| 1:4 | 3288 | 651.2 | 8.6 | 12110 | 382.3 | 5.05 |
| 1:2 | 6825 | 468.2 | 1.0 | 8039 | 6825 | 14.57 |
| 1:1.3 | 6246 | 514.9 | 1.7 | 8814 | 3674 | 12.13 |
| Sample |
Component (wt %) |
||
|---|---|---|---|
| Mg | Ca | SO4 | |
| Bittern | 4.63 | 1.71 | 0.0056 |
| Decalcium bittern | 5.65 | 0.03 | 1.32 |
| Sample | pH |
Component (wt %) |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| Mg(OH)2 | CaO | SiO2 | Al2O3 | Fe2O3 | K2O | Na2O | SO2 | ||
| 2M NH4OH | 11 | 99.1 | - | 0.2 | 0.2 | - | 0.1 | - | 0.7 |
| 2M NaOH | 13.8 | 96.0 | 3.8 | - | 0.1 | - | - | 0.1 | - |
- 1. H. Gui, X. Zhang, W. Dong, Q. Wang, J. Gao, Z. Song, J. Lai, Y. Liu, F. Huang and J. Qiao: Polymer, 48 (2007) 2537.Article
- 2. A. S. Bhatti, D. Dollimore and A. Dyer: Clay Miner., 19 (1984) 865.Article
- 3. L. Qiu, R. Xie, P. Ding and B. Qu: Compos. Struct., 62 (2003) 391.Article
- 4. J. Chen, L. Lin, Y Song and L Shao: J. Cryst. Growth, 311 (2009) 2405.Article
- 5. N. Um and T. Hirato: Hydrometallurgy, 146 (2014) 142.Article
- 6. J. Jakić, M. Labor and V. Martinac: J., Chem. Biochem. Eng. Q, 30 (2016) 373.Article
- 7. T. Y. Cho and M. J. Kim: J. of Korean Inst. of Resources Recycling, 25 (2016) 32.Article
- 8. J. Shukla, V. P. Mohandas and A. Kimar: J. Chem. Eng., 53 (2008) 2797.Article
- 9. Y. Zhang, Z. Yang, D. Guo, H. Geng and C. Dong: Procedia Environ. Sci., 18 (2013) 84.Article
- 10. Y. H. Yu, D. J. Hwang, Y. J. Ahn, K. H. Cho, J. W. Ahn and J. S. Choi: J. Korean Soc. Miner. Energy Resour. Eng., 58 (2021) 107.Article
- 11. G. Azimi, V.G. Papangelakisa and J. E. Dutrizac: Fluid Phase Equilib., 260 (2007) 300.Article
- 12. J. C. Yu, A. Xu, L. Zhang, R. Song and L. Wu: J. Phys. Chem., 108 (2004) 64.Article
References
Figure & Data
References
Citations

- Synthesis and Morphology Control of Needle Type 513 MHSH and Mg(OH)2 from Dolomite
Jiyeon Kim, HyunSeung Shim, Seong-Ju Hwang, YooJin Kim
Journal of Powder Materials.2025; 32(5): 399. CrossRef
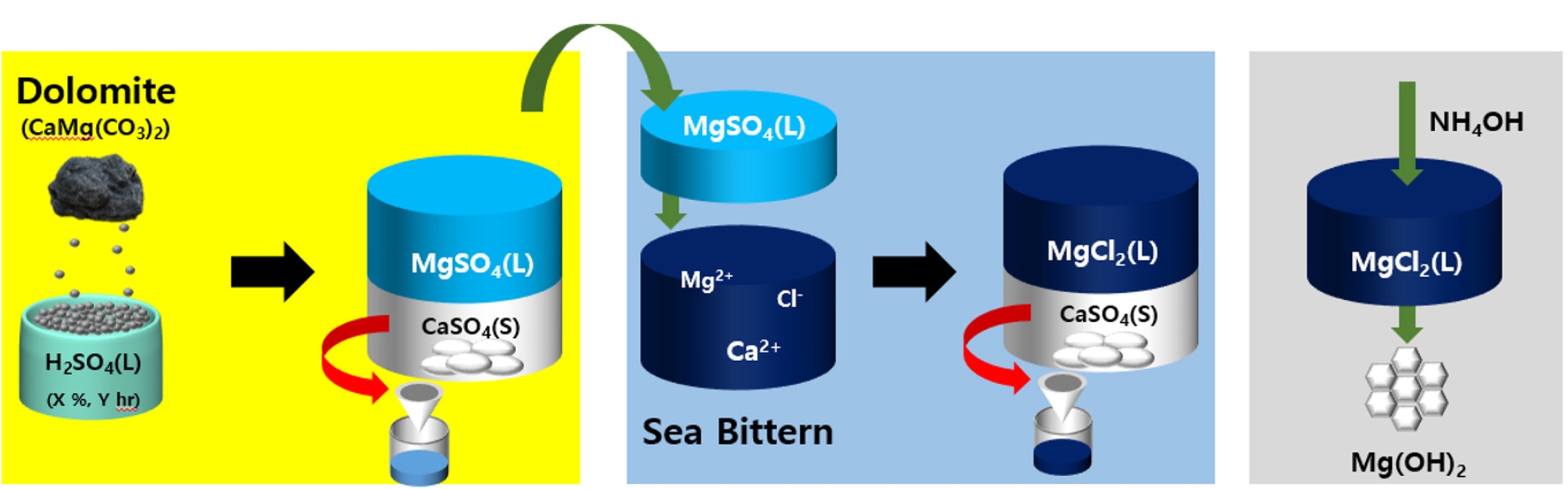
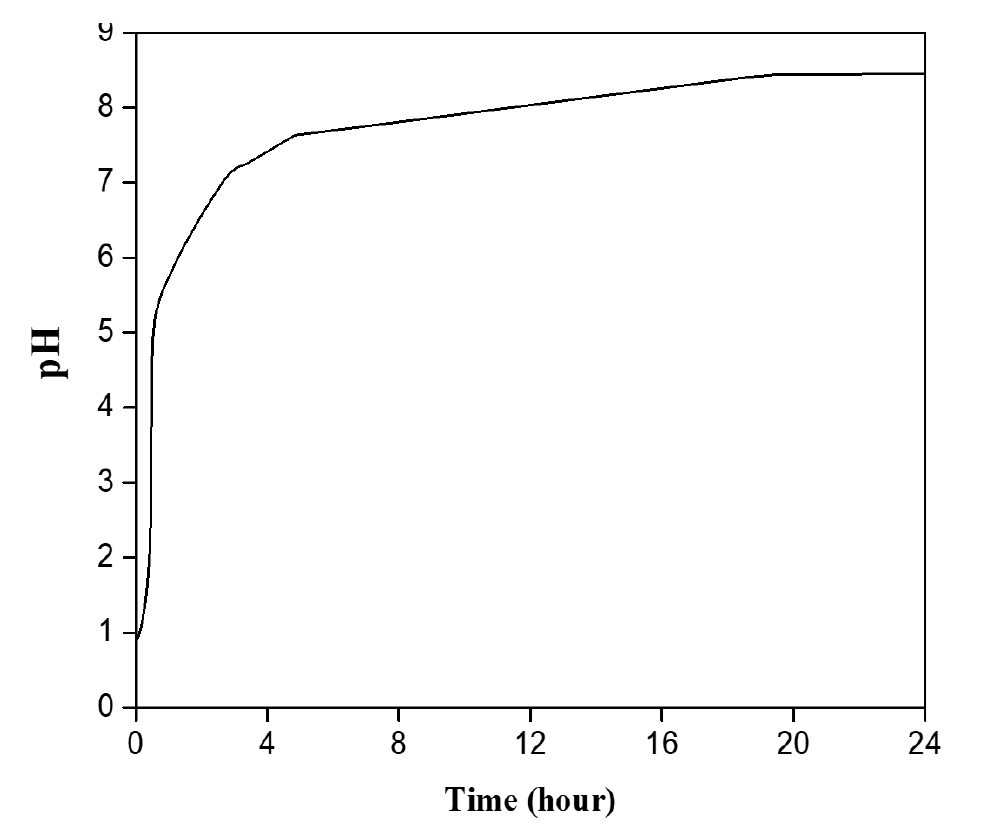
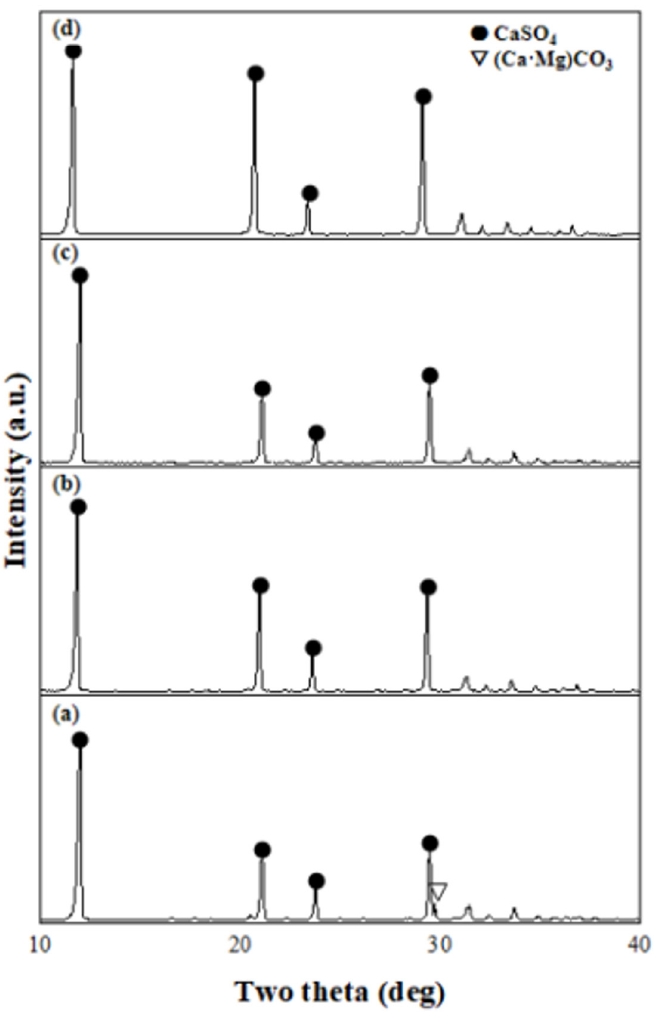
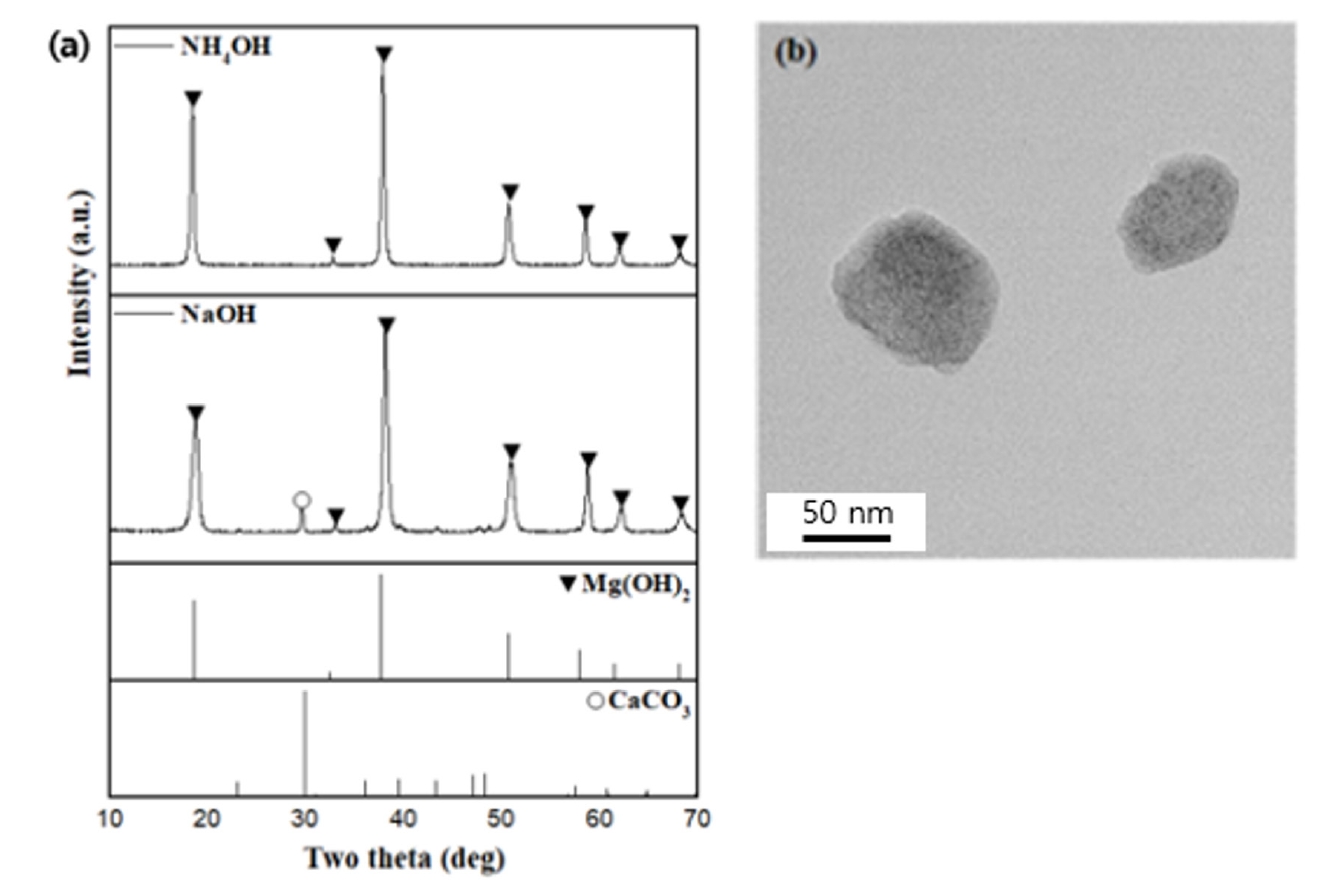
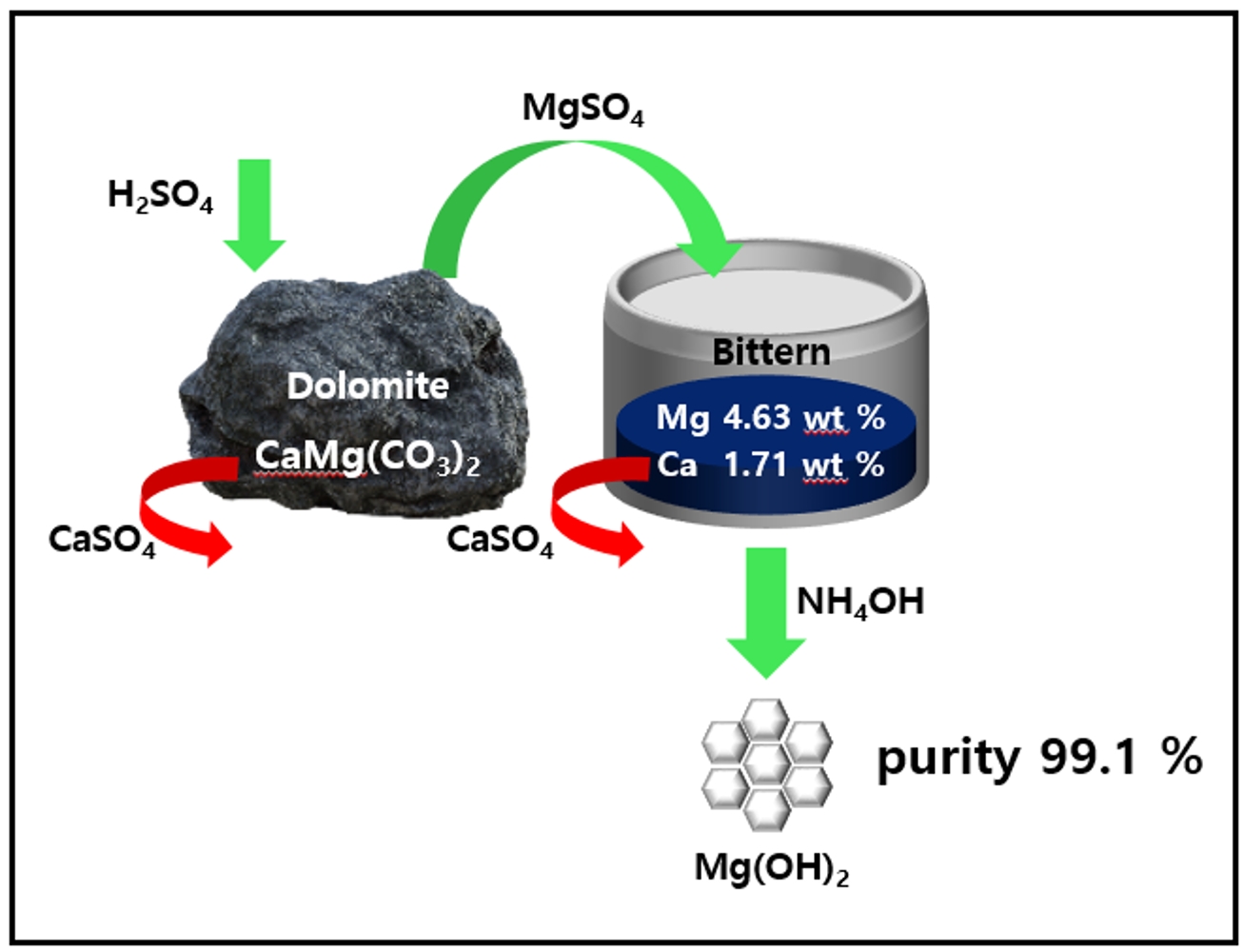
Fig. 1.
Fig. 2.
Fig. 3.
Fig. 4.
Graphical abstract
| Condition | Sample | Dolomite (g) | H2SO4 (%) | Mole ratio (Dolomite:H2SO4) | Stirring time (h) |
|---|---|---|---|---|---|
| Ⅰ | 1 | 10 | 1 | 1:2 | 24 |
| 2 | 10 | 5 | 1:2 | 24 | |
| 3 | 11 | 10 | 1:2 | 24 | |
| Ⅱ | 4 | 5 | 5 | 1:4 | 24 |
| 5 | 10 | 5 | 1:2 | 24 | |
| 6 | 15 | 5 | 1:1.3 | 24 | |
| Ⅲ | 7 | 10 | 5 | 1:2 | 2 |
| 8 | 10 | 5 | 1:2 | 4 | |
| 9 | 10 | 5 | 1:2 | 6 | |
| 10 | 10 | 5 | 1:2 | 24 |
| Sample | Component (wt %) |
|||||
|---|---|---|---|---|---|---|
| CaO | MgO | SiO2 | Al2O3 | Fe2O3 | Total (Except for Mg, Ca) | |
| W | 30.6 | 21.3 | 0.33 | 0.21 | 0.17 | 0.71 |
| K | 30.5 | 21.7 | 0.22 | 0.12 | 0.09 | 0.43 |
| S | 30.9 | 21.3 | 0.21 | 0.18 | 0.14 | 0.54 |
| D | 30.8 | 21.6 | 0.15 | 0.08 | 0.08 | 0.30 |
| Sample | Component (wt %) |
|||||
|---|---|---|---|---|---|---|
| Cl- | SO42- | Ca2+ | Mg2+ | K+ | Na+ | |
| Sea water | 1.93 | 0.27 | 0.04 | 0.13 | 0.04 | 1.07 |
| Sea bittern | 16.82 | 0.006 | 1.66 | 3.30 | 4.21 | 2.65 |
| Sea bittern/Sea water | 8.72 | 0.02 | 41.5 | 25.4 | 105 | 2.48 |
| Sample (H2SO4) | Component (ppm) |
Ratio (%) |
||||
|---|---|---|---|---|---|---|
| Mg | Ca | Si | S | Mg/Si | Mg/Ca | |
| 1 % | 1304 | 529.8 | 5 | 2001 | 260.8 | 2.46 |
| 5 % | 3288 | 651.2 | 8.6 | 12110 | 382.3 | 5.05 |
| 10 % | 3357 | 703.4 | 9.1 | 33310 | 368.9 | 4.77 |
| Sample (Dolimite:H2SO4) | Component (ppm) |
Ratio (%) |
||||
|---|---|---|---|---|---|---|
| Mg | Ca | Si | S | Mg/Si | Mg/Ca | |
| 1:4 | 3288 | 651.2 | 8.6 | 12110 | 382.3 | 5.05 |
| 1:2 | 6825 | 468.2 | 1.0 | 8039 | 6825 | 14.57 |
| 1:1.3 | 6246 | 514.9 | 1.7 | 8814 | 3674 | 12.13 |
| Sample (time) | Component (ppm) |
Ratio (%) |
||||
|---|---|---|---|---|---|---|
| Mg | Ca | Si | S | Mg/Si | Mg/Ca | |
| 2 h | 7419 | 483.3 | 1.7 | 8762 | 4364.1 | 15.4 |
| 4 h | 7956 | 434.6 | 52.3 | 9421 | 152.1 | 18.3 |
| 6 h | 6571 | 571.7 | 122.8 | 10070 | 53.5 | 11.5 |
| 24 h | 7326 | 533.7 | 160.1 | 9244 | 45.8 | 13.7 |
| Sample | Component (wt %) |
||
|---|---|---|---|
| Mg | Ca | SO4 | |
| Bittern | 4.63 | 1.71 | 0.0056 |
| Decalcium bittern | 5.65 | 0.03 | 1.32 |
| Sample | pH | Component (wt %) |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| Mg(OH)2 | CaO | SiO2 | Al2O3 | Fe2O3 | K2O | Na2O | SO2 | ||
| 2M NH4OH | 11 | 99.1 | - | 0.2 | 0.2 | - | 0.1 | - | 0.7 |
| 2M NaOH | 13.8 | 96.0 | 3.8 | - | 0.1 | - | - | 0.1 | - |
Table 1.
Table 2.
Table 3.
Table 4.
Table 5.
Table 6.
Table 7.
Table 8.
TOP
 KPMI
KPMI

 ePub Link
ePub Link Cite this Article
Cite this Article